题目内容
【题目】 X、Y、Z、M、Q是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表
元素 | 结构或性质信息 |
X | 其原子最外层电子数是内层电子数的2倍 |
Y | 基态原子最外层电子排布为nsnnpn+1 |
Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
M | 单质在常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
Q | 其与X形成的合金为目前用量最多的金属材料 |
(1)Q元素基态原子的电子排布式是________,Y原子的电子排布图是 。
(2)比较Y元素与氧元素的第一电离能____>____;X和Z形成的化合物XZ2为一种液体溶剂,其化学式是 ,分子中的![]() 键和
键和![]() 键数目之比为_____。
键数目之比为_____。
(3)写出实验室制备M单质的离子方程式 。
(4)M的气态氢化物和氟化氢相比(写化学式)
稳定性强的是_____________,其原因是_____________________;
沸点高的是_____________,其原因是_____________________。
【答案】(1)[Ar]3d64s2 或 1s22s22p63s23p63d64s2 ![]()
(2)N > O ; CS2 1:1
(3)MnO2+ 2Cl-+4H+△Cl2↑+Mn2+ +2H2O
(4)HF>HCl 因为元素非金属性F>Cl, 所以HF稳定;
HF>HCl 因为HF分子之间存在氢键,所以HF沸点高。
【解析】
试题分析:X原子最外层电子数是内层电子数的2倍,最外层最多含有8个电子,则X含有两个电子层,最外层含有4个C,则X为C元素;Y的基态原子最外层电子排布为nsnnpn+1,s层含有2个电子,则n=2,Y的最外层电子排布式为:2s22p3,则Y为N元素;Z为非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰,则Z为S元素;基态原子的M层上有1个未成对的p电子,则M的电子排布式为1s22s22p63s23p1或1s22s22p63s23p5,为铝元素或氯元素,由于Z单质常温、常压下是气体,所以Z是Cl元素;Q与X形成的合金为目前用量最多的金属材料,该合金为钢,则Q为Fe元素,
综上所述:X、Y、Z、M、Q分别为C、N、S、Cl、Fe元素。
(1)Q为Fe元素,铁原子核外有26个电子,基态原子的电子排布式为:1s22s22p63s23p63d64s2,Y为氮元素,电子排布为:![]() 。(2)核外电子排布处于半充满、全充满、全空是稳定结构,N原子的2p能级是半充满状态,是稳定状态,因此第一电离能N>O;X和Z形成的化合物XZ2为CS2,结构为S=C=S,σ键和π键数目之比为1:1。(3)M为氯元素,其单质为氯气,实验室用二氧化锰与浓盐酸反应制取氯气,反应的离子方程式为:MnO2+ 2Cl-+4H+△Cl2↑+Mn2+ +2H2O 。(4)非金属性越强,对应气态氢化物越稳定,非金属性:F>Cl,则氢化物的稳定性HF>HCl;由于HF分子间存在氢键,所以氟化氢的沸点比HCl高,
。(2)核外电子排布处于半充满、全充满、全空是稳定结构,N原子的2p能级是半充满状态,是稳定状态,因此第一电离能N>O;X和Z形成的化合物XZ2为CS2,结构为S=C=S,σ键和π键数目之比为1:1。(3)M为氯元素,其单质为氯气,实验室用二氧化锰与浓盐酸反应制取氯气,反应的离子方程式为:MnO2+ 2Cl-+4H+△Cl2↑+Mn2+ +2H2O 。(4)非金属性越强,对应气态氢化物越稳定,非金属性:F>Cl,则氢化物的稳定性HF>HCl;由于HF分子间存在氢键,所以氟化氢的沸点比HCl高,

 名校课堂系列答案
名校课堂系列答案【题目】 I.在实验室利用下列装置,可制备某些气体并验证其化学性质。
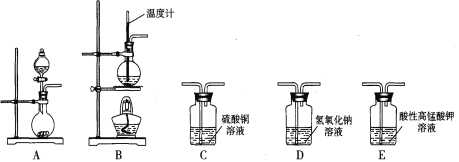
完成下列表格:
序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
(1) | 乙烯 | __________________ | _________________________ |
(2) | 乙炔 | A→C→E | _________________________ |
II.工业上用乙烯、氯化氢和氯气为原料,经下列各步合成聚氯乙烯(PVC):

A的结构简式是__________________________________________________;
反应④的化学方程式是_________________________________________。
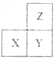
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。
A | C | |
B |
A、C两元素的原子核外电子数之和等于B原子的质子数。
(1)写出A、B元素的名称 、 。
(2)B位于元素周期表中第 周期第 族。
(3)C的原子结构示意图为 。
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式 。