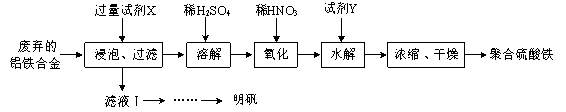
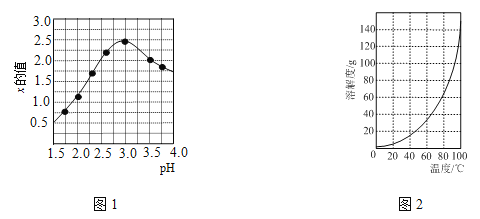
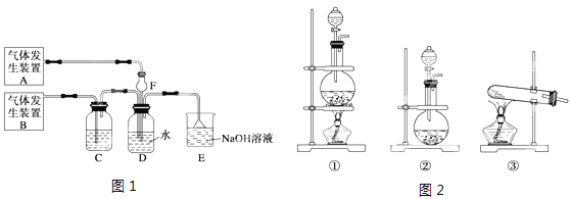
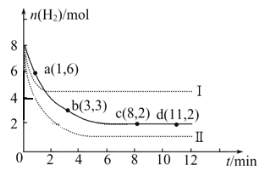
题目内容
【题目】下列不能形成配位键的是( )
A.Ag+ NH3 B.Cu2+ NH3 C.H+ H2O D.Ag+ CH4
【答案】D
【解析】
试题分析:含有孤电子对和含有空轨道的原子之间能形成配位键,配位键属于共价键,根据配位键形成的条件分析,一方要提供空轨道,另一方提供孤电子对,据此进行答题.
解:A.Ag+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,故A不选;
B.Cu2+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,故B不选;
C.水分子中的O原子含有孤电子对,H+有空轨道,所以能形成配位键,故C不选;
D.Ag+有空轨道,Ag+、CH4两种微粒都没有孤电子对,所以不能形成配位键,故D选;
故选D.

练习册系列答案
相关题目
【题目】 X、Y、Z、M、Q是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表
元素 | 结构或性质信息 |
X | 其原子最外层电子数是内层电子数的2倍 |
Y | 基态原子最外层电子排布为nsnnpn+1 |
Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
M | 单质在常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
Q | 其与X形成的合金为目前用量最多的金属材料 |
(1)Q元素基态原子的电子排布式是________,Y原子的电子排布图是 。
(2)比较Y元素与氧元素的第一电离能____>____;X和Z形成的化合物XZ2为一种液体溶剂,其化学式是 ,分子中的![]() 键和
键和![]() 键数目之比为_____。
键数目之比为_____。
(3)写出实验室制备M单质的离子方程式 。
(4)M的气态氢化物和氟化氢相比(写化学式)
稳定性强的是_____________,其原因是_____________________;
沸点高的是_____________,其原因是_____________________。