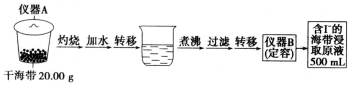
题目内容
【题目】磷及其化合物在科研及生产中均有着重要的应用。
(1)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为 。
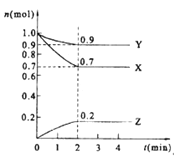
(2)可逆反应PCl3(g)+Cl2(g)![]() PCl5(g) 2E(g)
PCl5(g) 2E(g)![]() F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
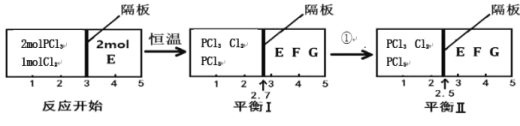
①达到平衡I时,体系压强与反应开始时体系压强之比为 。
②平衡I到平衡II的条件①是 (填“升温”或“降温”)。
(3)亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3。电解Na2HPO3溶液也可得到亚磷酸,装置如图所示:

阴极的电极反应式为________________;产品室中反应的离子方程式为 。
(4)一定温度下,Ksp [Mg3(PO4)2] =6.0×10-29,Ksp [Ca3(PO4)2] =6.0×10-26。向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成 沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c= mol/L。
【答案】(1)PCl5(g) ![]() PCl3(g) + Cl2(g) △H=+93kJ/mol
PCl3(g) + Cl2(g) △H=+93kJ/mol
(2)①20:23 ②降温
(3)2H++2e—=H2↑; HPO32—+2H+=H3PO3
(4)Mg3(PO4)2; 10-4
【解析】
试题分析:(1)已知:①2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol,②2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol,根据盖斯定律:(①-②)÷2得气态PCl5生成气态PCl3和Cl2的热化学方程式为PCl5(g) ![]() PCl3(g) + Cl2(g) △H=+93kJ/mol。
PCl3(g) + Cl2(g) △H=+93kJ/mol。
(2)①右室的混合气体的物质的量不变为2mol,左右两室的压强、温度相等,同温同压下,气体的体积之比等于物质的量之比,平衡(I)中左室混合气体的物质的量为2.7/2.3×2mol=54/23mol,反应过程中温度不变,根据阿伏加德罗定律知达到平衡I时,体系压强与反应开始时体系压强之比为20:23;②又可逆反应PCl3(g)+Cl2(g)![]() PCl5(g)为放热反应,根据平衡I到平衡II,左边气体物质的量变小,故平衡正向移动,改变的条件为降温。
PCl5(g)为放热反应,根据平衡I到平衡II,左边气体物质的量变小,故平衡正向移动,改变的条件为降温。
(3)电解Na2HPO3溶液制备亚磷酸,阴极上溶液中的H+得电子生成氢气,电极反应式为2H++2e—=H2↑;硫酸溶液的H+透过阳膜进入产品室中,Na2HPO3溶液中的HPO3—透过阴膜进入产品室,二者反应生成亚磷酸,反应的离子方程式为HPO32—+2H+=H3PO3。
(4)磷酸钙和磷酸镁组成和结构相似,由二者的溶度积常数判断:则磷酸镁的溶解度小于磷酸钙,故向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成Mg3(PO4)2沉淀;当溶液中Mg2+沉淀完全时,根据Ksp [Mg3(PO4)2] =6.0×10-29计算溶液中c2(PO43—)= 6.0×10-14,根据Ksp [Ca3(PO4)2] =6.0×10-26计算溶液中Ca2+的物质的量浓度c= 10-4mol/L。

【题目】下图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
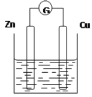
实验后的记录: ①正极的电极反应式:Zn―2e―=Zn2+ ②H+向负极移动 ③电子流动方向Zn→Cu ④在Cu处产生1.12L H2,则电路中一定有0.1mol电子通过 |
(1)在卡片上,叙述合理的是 (填序号)。
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,原因可能是 。
(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因是 。
【题目】 X、Y、Z、M、Q是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表
元素 | 结构或性质信息 |
X | 其原子最外层电子数是内层电子数的2倍 |
Y | 基态原子最外层电子排布为nsnnpn+1 |
Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
M | 单质在常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
Q | 其与X形成的合金为目前用量最多的金属材料 |
(1)Q元素基态原子的电子排布式是________,Y原子的电子排布图是 。
(2)比较Y元素与氧元素的第一电离能____>____;X和Z形成的化合物XZ2为一种液体溶剂,其化学式是 ,分子中的![]() 键和
键和![]() 键数目之比为_____。
键数目之比为_____。
(3)写出实验室制备M单质的离子方程式 。
(4)M的气态氢化物和氟化氢相比(写化学式)
稳定性强的是_____________,其原因是_____________________;
沸点高的是_____________,其原因是_____________________。