题目内容
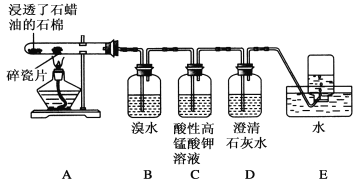
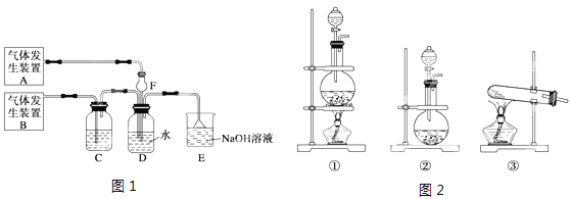
【题目】 I.在实验室利用下列装置,可制备某些气体并验证其化学性质。
完成下列表格:
序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
(1) | 乙烯 | __________________ | _________________________ |
(2) | 乙炔 | A→C→E | _________________________ |
II.工业上用乙烯、氯化氢和氯气为原料,经下列各步合成聚氯乙烯(PVC):

A的结构简式是__________________________________________________;
反应④的化学方程式是_________________________________________。
【答案】I.(1)B→D→E(答全,得2分)
![]() (2分)
(2分)
(2)![]() (2分)
(2分)
Ⅱ.CH2ClCH2Cl (2分)
 (2分)
(2分)
【解析】
试题分析:I.(1)在实验室中制取乙烯,需要加热到170℃,应该选择B装置,反应中会发生副反应生成二氧化硫,必须用氢氧化钠溶液除去,所以选择D装置除去二氧化硫杂质,最后用高锰酸钾溶液检验乙烯的性质,所以连接顺序为: B→D→E;实验室利用乙醇能发生消去反应制乙烯:![]() 。(2)实验室制取乙炔的化学反应方程式为:
。(2)实验室制取乙炔的化学反应方程式为:![]() 。Ⅱ.CH2=CH2可与氯气发生加成反应生成CH2Cl-CH2Cl,CH2Cl-CH2Cl发生消去反应生成CH2=CHCl,CH2=CHCl发生加聚反应可生成PVC,反应(4)方程式为
。Ⅱ.CH2=CH2可与氯气发生加成反应生成CH2Cl-CH2Cl,CH2Cl-CH2Cl发生消去反应生成CH2=CHCl,CH2=CHCl发生加聚反应可生成PVC,反应(4)方程式为
 。
。

【题目】下图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
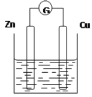
实验后的记录: ①正极的电极反应式:Zn―2e―=Zn2+ ②H+向负极移动 ③电子流动方向Zn→Cu ④在Cu处产生1.12L H2,则电路中一定有0.1mol电子通过 |
(1)在卡片上,叙述合理的是 (填序号)。
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,原因可能是 。
(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因是 。
【题目】 X、Y、Z、M、Q是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表
元素 | 结构或性质信息 |
X | 其原子最外层电子数是内层电子数的2倍 |
Y | 基态原子最外层电子排布为nsnnpn+1 |
Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
M | 单质在常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
Q | 其与X形成的合金为目前用量最多的金属材料 |
(1)Q元素基态原子的电子排布式是________,Y原子的电子排布图是 。
(2)比较Y元素与氧元素的第一电离能____>____;X和Z形成的化合物XZ2为一种液体溶剂,其化学式是 ,分子中的![]() 键和
键和![]() 键数目之比为_____。
键数目之比为_____。
(3)写出实验室制备M单质的离子方程式 。
(4)M的气态氢化物和氟化氢相比(写化学式)
稳定性强的是_____________,其原因是_____________________;
沸点高的是_____________,其原因是_____________________。