题目内容
12.下列各反应属于加成反应的是( )| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | B. | 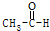 +H2$\stackrel{催化剂}{→}$CH3CH2OH +H2$\stackrel{催化剂}{→}$CH3CH2OH | ||
| C. | H2+Cl2═2HCl | D. | 2CH3CH2OH+O2→2CH3CHO+2H2O |
分析 根据加成反应是有机物分子中的不饱和键发生断裂,不饱和原子直接与其它原子或原子团相结合,生成新的化合物的反应进行分析.
解答 解:A.甲烷燃烧属于氧化反应,故A错误;
B.乙醛被还原为乙醇,CH3CHO中碳氧双键中一个键断裂,分别结合了氢原子生成CH3CH2OH,属于加成反应,故B正确;
C.氢气和氯气化合生成氯化氢属于化合反应,故C错误;
D.乙醇催化氧化制乙醛,属于氧化反应,故D错误;
故选B.
点评 本题考查学生有机化学中的反应类型,注意各反应类型的特征是解题的关键所在,难度不大.

练习册系列答案
相关题目
13.下列物质属于烃的是( )
| A. | C2H5Br | B. | C2H6 | C. | C2H5OH | D. | CH3COOH |
7.下列关于氯水的叙述,正确的是( )
| A. | 氯水中只含Cl2和HClO两种分子 | |
| B. | 新制氯水只能使蓝色石蕊试纸变红 | |
| C. | 光照氯水有气泡逸出,该气体主要是Cl2 | |
| D. | 氯水放置数天后其pH将变小,酸性增强 |
17.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
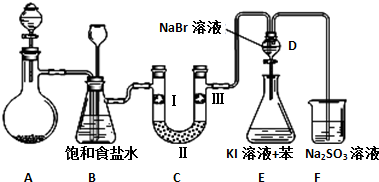
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl,同时装置B亦是安全瓶,可用来监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是d(填编号);
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是E中溶液分为两层,上层(苯层)为紫红色,事实上该现象并不能说明溴的非金属性强于碘,原因是Cl2+2I-=I2+2Cl-(用离子反应方程式解释);
(5)从原子结构角度解释氯、溴、碘的非金属性强弱递变规律及原因氯、溴、碘同主族,从上到下,原子半径逐渐增大,得电子能力减弱,元素非金属性减弱;
(6)装置F的目的是吸收余氯,试写出相应的离子反应方程式SO32-+Cl2+H2O=SO42-+2Cl-+2H+.

(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl,同时装置B亦是安全瓶,可用来监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是d(填编号);
| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)从原子结构角度解释氯、溴、碘的非金属性强弱递变规律及原因氯、溴、碘同主族,从上到下,原子半径逐渐增大,得电子能力减弱,元素非金属性减弱;
(6)装置F的目的是吸收余氯,试写出相应的离子反应方程式SO32-+Cl2+H2O=SO42-+2Cl-+2H+.
4.桶烯(Barrelene)的结构简式如图所示,则下列有关说法不正确的是( )
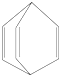

| A. | 桶烯分子中所有原子在同一平面内 | |
| B. | 桶烯在一定条件下能发生加成反应和聚合反应 | |
| C. | 桶烯与苯乙烯(C6H5CH═CH2)互为同分异构体 | |
| D. | 桶烯中的一个氢原子被氯原子取代,所得产物只有一种 |
2.下列操作正确的是( )
| A. | 制溴苯时,将导气管插入水中使其充分吸收尾气 | |
| B. | 配制新制Cu(OH)2悬浊液:在一定量CuSO4溶液中,滴加少量NaOH溶液 | |
| C. | 只用溴水一种试剂可鉴别出甲苯、己烯、乙醇、四氯化碳四种液体 | |
| D. | 制取乙酸乙酯实验中,在一定量乙醇中,依次加入0.5mol/L的H2SO4和乙酸后加热 |
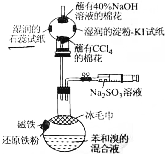 溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应.
溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应.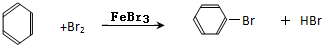 ,冰毛巾覆盖在圆底烧瓶上半部分的目的是降低温度圆底烧瓶上部温度,起冷却回流作用;
,冰毛巾覆盖在圆底烧瓶上半部分的目的是降低温度圆底烧瓶上部温度,起冷却回流作用;