题目内容
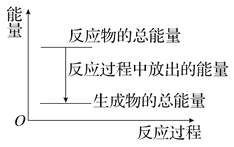
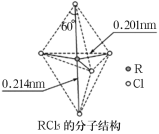
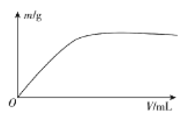
【题目】短周期主族元素X、Y、Z、W,已知X的某种氢化物可使溴的四氯化碳溶液褪色,X原子电子占据2个电子层;Y广泛作电池材料且单位质量的金属提供电子数目最多;实验室可用Z的氢化物的浓溶液和![]() 固体在常温下制备Z的单质;向含W元素的含氧酸钠盐溶液中通入X的氧化物,观察到沉淀质量(m)与X的氧化物体积(V)关系如图所示。下列说法正确的是( )
固体在常温下制备Z的单质;向含W元素的含氧酸钠盐溶液中通入X的氧化物,观察到沉淀质量(m)与X的氧化物体积(V)关系如图所示。下列说法正确的是( )
A.Y的单质在空气中燃烧生成过氧化物和氮化物
B.X的含氧酸的酸性可能比Z的含氧酸的酸性强
C.Z和W组成的化合物一定是非电解质
D.X、Z、W原子半径的大小不能比较
【答案】B
【解析】
短周期主族元素X、Y、Z、W,已知X的某种氢化物可使溴的四氯化碳溶液褪色,X原子电子占据2个电子层,则X为C元素;Y广泛作电池材料且单位质量的金属提供电子数目最多,则Y为Li;实验室可用Z的简单氢化物的浓溶液和KMnO4固体在常温下制备Z的单质,则Z为Cl元素;向含W元素的钠盐溶液中通入X(C)的氧化物,观察到沉淀质量(m)与X的氧化物体积(V)关系如图所示,该钠盐为偏铝酸钠或硅酸钠,则W为Al或Si元素,据此解答。
根据分析可知,X为C,Y为Li,Z为Cl,W为Al(或Si)元素。
A.Li金属性小于Na,在空气中Li燃烧生成氧化锂,故A错误;
B.X的含氧酸碳酸的酸性大于Cl的含氧酸次氯酸的酸性,故B正确;
C.Cl与Si形成四氯化硅,与Al形成氯化铝,氯化铝是电解质,而四氯化硅则是非电解质,故C错误;
D.根据同周期主族元素原子半径从左往右依次减小,同主族从上往下原子半径依次增大,一般电子层数越多半径越大,故C、Al或Si、Cl原子半径的大小顺序为:Al(Si)>Cl>C,故D错误;
故选:B。

练习册系列答案
相关题目