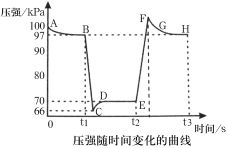
题目内容
【题目】已知:①标准状况下,1体积水中最多能溶解500体积的HCl;②饱和NaCl溶液的浓度约为5.00mol/L 。将448L(标准状况下)HCl气体溶于1L水中,所得溶液A的密度为1.20g·cm-3,则溶液A中HCl的物质的量浓度为__________。(本题计算结果均取三位有效数字)
(1)若使1L饱和NaCl溶液中的Cl-浓度与溶液A中的Cl-浓度相等,则在1L饱和NaCl溶液中还应溶解__________L标准状况下的HCl气体(溶液体积变化忽略不计)。
(2)若将10.0mL溶液A稀释成500mL溶液B,则溶液B中HCl的物质的量浓度为__________。
(3)在溶液B的配制过程中,使用前必须检查是否漏液的仪器是__________。
【答案】13.9mol·L-1 199 0.278mol·L-1 容量瓶
【解析】
HCl和水的质量可以求出,已知密度,则可求溶液的体积,再根据![]() 求浓度;
求浓度;
(1)饱和NaCl溶液的浓度约为5.00molL-1,根据两者的浓度差计算需溶解的氯化氢的量;
(2)若将10.0mL溶液A稀释成500mL溶液B,溶液体积增大50倍,则溶液B中HCl的物质的量浓度变为A中的![]() ,据此分析计算;
,据此分析计算;
(3)在配制一定物质的量浓度溶液的过程中,容量瓶一定要检查是否漏液。
解析:标准状况下,448LHCl为20mol,溶液A的体积为![]() ,则
,则![]() 。
。
(1)Cl-的物质的量浓度相差(13.9-5.00)mol·L-1=8.9mol·L-1,需溶解标准状况下的HCl气体的体积为8.9mol·L-1×1L×22.4L·mol-1=199L,故答案为199;
(2) 若将10.0mL溶液A稀释成500mL溶液B,溶液体积增大50倍,则溶液B中HCl的物质的量浓度变为A中的![]() ,即变为13.9mol/L×
,即变为13.9mol/L×![]() =0.278mol/L,故答案为:0.278mol/L;
=0.278mol/L,故答案为:0.278mol/L;
(3)配制溶液前要检查容量瓶是否漏液,故答案为:容量瓶。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】参考下列图表和有关要求回答问题:
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”“减小”或“不变”,下同),ΔH的变化是__。请写出NO2和CO反应的热化学方程式:__。

(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:___。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | a | b | c | x |
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=___kJ·mol-1(用含有a、b、c、d的代数式表示)。