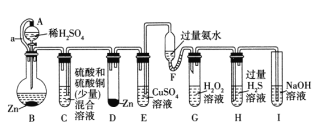
题目内容
【题目】人体血液的pH通常在7.35-7.45之间的原因是血液中存在NaH2PO4-Na2HPO4等缓冲体系。常温下:Ka1(H3PO4)=7.6×10-3、Ka2(H3PO4)=6.3×10-8。下列指定溶液中微粒物质的量浓度关系正确的是
A.0.1mol/L NaH2PO4溶液:2c(HPO42-)+3c(PO43-)>c(Na+)-c(H2PO4-)
B.常温下,pH=7的NaH2PO4和Na2HPO4的混合溶液:c(Na+)>c(HPO42-)>c(H2PO4-)
C.向10 mL0.1mol/L NaH2PO4溶液中加入5mL 0.4 mol/L NaOH溶液:c(H+)+3c(H3PO4)+2c(H2PO4-)+c(HPO42-)=c(OH-)
D.物质的量浓度相等NaH2PO4和Na2HPO4溶液等体积混合:3[c(H2PO4-)+c(HPO42-)+c(PO43-)]=2c(Na+)
【答案】AC
【解析】
A.根据溶液中电荷守恒可得![]() ,0.1mol/L NaH2PO4溶液显酸性,c(H+)>c(OH-),则
,0.1mol/L NaH2PO4溶液显酸性,c(H+)>c(OH-),则![]() ,故A正确;
,故A正确;
B.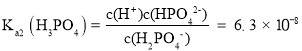 ,pH=7,c(H+)=10-7mol/L,则
,pH=7,c(H+)=10-7mol/L,则![]() ,Na+不发生水解,则c(Na+)>c(H2PO4-)>c(HPO42-),故B错误;
,Na+不发生水解,则c(Na+)>c(H2PO4-)>c(HPO42-),故B错误;
C. 向10 mL0.1mol/L NaH2PO4溶液中加入5mL 0.4 mol/L NaOH溶液,此时溶液为Na3PO4,根据溶液中质子守恒可得![]() ,故C正确;
,故C正确;
D. 物质的量浓度相等NaH2PO4和Na2HPO4溶液等体积混合,根据物料守恒,2Na=3P,可得![]() ,故D错误;
,故D错误;
故答案选:AC。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
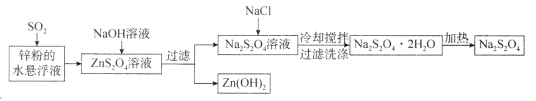
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】重铬酸钾(K2Cr2O7)常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如图所示。

已知:I.在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II.相关金属离子形成氢氧化物沉淀的pH范围:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Cr3+ | 4.9 | 6.8 |
Fe3+ | 1.5 | 2.8 |
回答下列问题:
(1)滤渣②的成分是________________。
(2)写出“氧化”步骤中反应的化学方程式________________。
(3)“加热”操作的目的是________________。
(4)根据平衡移动原理解释酸化至pH=1的目的是________________(用离子方程式和适当文字说明)。
(5)通过下列实验可测定产品中K2Cr2O7(M=294g/mol)的纯度:称取重铬酸钾试样1.470g,用100mL容量瓶配制成溶液。移取25.00mL溶液于碘量瓶中,加入适量稀硫酸和足量碘化钾(Cr2O72-的还原产物为Cr3+),放于暗处5min。然后加入一定量的水,加入淀粉指示剂,用0.1500mol/LNa2S2O3标准溶液滴定,共消耗标准液36.00mL。滴定时发生的反应的离子方程式为:I2+2S2O32-=2I-+S4O62-。则所测定产品中K2Cr2O7的纯度为________________。
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。

①负极的电极反应式为________________;
②一段时间后,中间室NaCl溶液的浓度________________(填“增大”“减小”或“不变”)。