【题目】汽车尾气及硝酸工业废气中氮氧化物的处理是治理环境污染的重要课题。
(1)汽车尾气中的NO(g)和CO(g)在一定条件下可发生如下反应:
反应I:2NO(g)+2CO(g) N2(g)+2CO2(g)△H1
N2(g)+2CO2(g)△H1
反应II:N2(g)+O2(g) 2NO(g)△H2=+180.5kJ·mol-1
2NO(g)△H2=+180.5kJ·mol-1
已知CO的燃烧热为283.0kJ·mol-1,则△H1=________________。
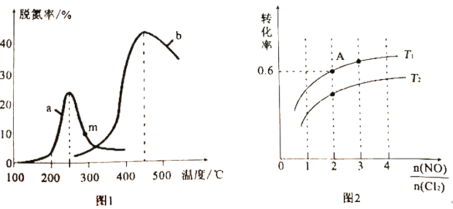
(2)某研究小组探究催化剂对上述反应I的影响。将NO和CO混合气体以定的流速分别通过两种不同的催化剂a和b进行反应,在相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),得到图1中a、b两条曲线。温度低于200℃时,图1中曲线a脱氮率随温度升高而变化不大的主要原因为________________;m点________________(填“是”或者“不是”)对应温度下的平衡脱氮率,说明理由________________。
(3)一定条件下Cl2也可以与NO反应,生成一种有机合成中的重要试剂亚硝酰氯(NOCl),化学方程式为:2NO(g)+Cl2(g) 2NOCl(g)△H<0。在恒温恒容条件下,将物质的量之和为3mol的NO(g)和Cl2(g)以不同的氮氯比[
2NOCl(g)△H<0。在恒温恒容条件下,将物质的量之和为3mol的NO(g)和Cl2(g)以不同的氮氯比[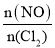 ]通入容器中进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图2所示。
]通入容器中进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图2所示。
①图2中T1、T2的关系为T1________________T2(填“>”“<”或“=”)。
②图2中纵坐标为反应物________________的转化率,理由为________________。
③若在温度为T1,容积为1L恒容密闭的容器中反应,经过10min到达A点,则0~10min内反应速率v(NO)=________________mol·L-1·min-1。
④已知:用气体分压替代浓度计算的平衡常数叫压强平衡常数(Kp);分压=总压×气体物质的量分数。若该反应的起始压强为P0kPa,T1温度下该反应的压强平衡常数(Kp)为________________(用含P0的代数式表示)。
![]() S
S
![]()
![]() S,故A错误;
S,故A错误;![]() ,故B正确;
,故B正确;![]() ,故C错误;
,故C错误;