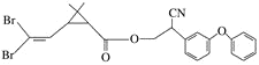
题目内容
【题目】利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验原理:电极(______、______)、________、________、稀硫酸、耳机(或者电流计)。(请在空格中填写所缺的实验用品)
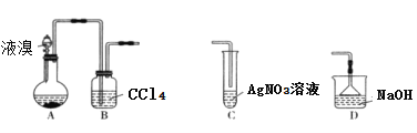
(3)实验装置(如图)。
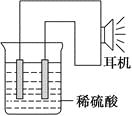
(4)原电池设计及注意的问题:
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓……”的声音。其原因是:在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是_____________________________,发生了________反应。
【答案】铁钉或铁条 铜片(其他合理答案也可) 烧杯、导线 电能 电能 负 Fe-2e-=Fe2+ 氧化
【解析】
(2)根据电池反应:Fe+2H+=Fe2++H2↑可知,正极为不比铁活泼的金属或非金属导体。因此电极是铁钉或铁条、铜片,要构成原电池还需要烧杯、导线、稀硫酸;
(4)①在原电池中,由化学能转化为电能,在耳机中又由电能转化为声音这种能量。
②如果将装置中的耳机改为电流计,由于铁为负极,应连接电流计的负极,电极反应是Fe-2e-=Fe2+,发生了氧化反应。

 阅读快车系列答案
阅读快车系列答案【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4![]() Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
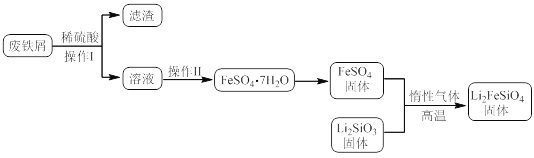
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
实验(二)Li2FeSiO4含量测定:
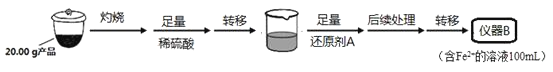
从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B__,仪器C__。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是__。
(3)操作Ⅱ的步骤__,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需__。
(4)还原剂A可用SO2,写出该反应的离子方程式__,此时后续处理的主要目的是__。
(5)滴定终点时现象为__;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为_。