题目内容
16.下列实验装置设计正确的是( )| A. | 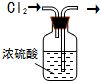 干燥氯气 | B. | 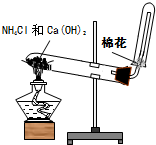 实验室制氨气 | ||
| C. |  电解精炼铜 | D. | 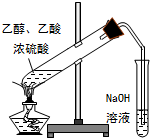 制乙酸乙酯 |
分析 A、装置中进气管应该伸入浓硫酸中,出气管露出液面;
B、大试管管口稍向下倾斜,收集氨气的试管口塞一团棉花;
C、电解精炼铜,粗铜应该连接电源的正极;
D、氢氧化钠能够与乙酸乙酯反应,不能够使用氢氧化钠溶液吸收产物.
解答 解:A、干燥氯气时,进气管必须伸入浓硫酸中,出气管应该露出液面,故A错误;
B、实验室制取氨气装置中,反应装置中大试管管口稍向下倾斜,收集氨气的试管口塞一团棉花,故B正确;
C、电解精炼铜时,阳极发生氧化反应,粗铜应该连接电源的正极,故C错误;
D、制取乙酸乙酯时,吸收装置中不能使用氢氧化钠溶液,应该使用饱和碳酸钠溶液,且通蒸气的导管要插在饱和的Na2CO3溶液的液面上而不能插入溶液中,防止溶液的倒吸,故D错误;
故选B.
点评 本题考查了气体的干燥、铜的电解、氨气的实验室制法、乙酸乙酯的制法等知识,题目难度不大,化学实验是化学的基础,要了解常见的实验操作,能对错误操作的后果做出判断,养成良好的实验习惯.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.依据题目要求回答下列问题.
(1)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如下表:
①上述盐溶液中的阴离子,结合H+能力最强的是CO32-
②据上表数据,请你判断下列反应不能成立的是D(填编号)
A、CH3COOH+Na2CO3═NaHCO3+CH3COONa
B、CH3COOH+NaCN═CH4COONa+HCN
C、CO2+H2O+NaClO═NaHCO3+HClO
D、CO2+H2O+2C4H5ONa═Na2CO3+2C8H5OH
③要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-═CO2+Cl-+HClO.
(2)已知温下Cu(OH)2的Ksp=2×10-20,又知常温下某CuSO4溶液里c(Cu2+)=0.02mol•L-1.如果要生成Cu(OH)2,则应调整溶液pH大于5.
(3)已知可逆反应FeO(g)+CO(g)?Fe(g)+CO2(g)是炼铁工业中一个重要反应,某温度与平衡常数K的关系如下表:
①写出该反应平衡常数的表达式:K=$\frac{c(CO)}{c(C{O}_{2})}$.
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的密度减小(选填“增大”“碱小”或“不变”):当$\frac{n(C{O}_{2})}{n(CO)}$=0.5,混合气体平均相对分子质量为33.3.
(1)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C4H4ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②据上表数据,请你判断下列反应不能成立的是D(填编号)
A、CH3COOH+Na2CO3═NaHCO3+CH3COONa
B、CH3COOH+NaCN═CH4COONa+HCN
C、CO2+H2O+NaClO═NaHCO3+HClO
D、CO2+H2O+2C4H5ONa═Na2CO3+2C8H5OH
③要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-═CO2+Cl-+HClO.
(2)已知温下Cu(OH)2的Ksp=2×10-20,又知常温下某CuSO4溶液里c(Cu2+)=0.02mol•L-1.如果要生成Cu(OH)2,则应调整溶液pH大于5.
(3)已知可逆反应FeO(g)+CO(g)?Fe(g)+CO2(g)是炼铁工业中一个重要反应,某温度与平衡常数K的关系如下表:
| T(K) | 933 | 1100 |
| K | 0.68 | 0.40 |
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的密度减小(选填“增大”“碱小”或“不变”):当$\frac{n(C{O}_{2})}{n(CO)}$=0.5,混合气体平均相对分子质量为33.3.
7.室温下,下列各组离子一定能大量共存的是( )
| A. | 含有大量Fe3+的溶液中:Ca2+、Na+、Cl-、Al3+ | |
| B. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| C. | 在c(H+)=10-13mol•L-1的溶液中:NO3-、K+、AlO2-、CO32- | |
| D. | 在与铝反应能够产生氢气的溶液中:K+、Fe2+、Cl-、NH4+ |
4.某有机物的结构简式为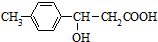 ,它可发生的有机反应的正确组合是( )
,它可发生的有机反应的正确组合是( )
①取代 ②加成 ③消去 ④水解 ⑤酯化 ⑥中和 ⑦氧化 ⑧加聚.
 ,它可发生的有机反应的正确组合是( )
,它可发生的有机反应的正确组合是( )①取代 ②加成 ③消去 ④水解 ⑤酯化 ⑥中和 ⑦氧化 ⑧加聚.
| A. | ①②③⑤⑥ | B. | ②③④⑥⑧ | C. | ①②③⑤⑥⑦ | D. | ④⑤⑥⑦⑧ |
11.根据磷元素的原子结构示意图(如图所示),做出如下推理,其中与事实不符的是( )
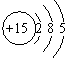
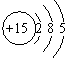
| A. | 磷元素位于元素周期表的第三周期、第ⅤA族 | |
| B. | 磷原子不如氮原子和硫原子的得电子能力强 | |
| C. | 磷的最高价氧化物对应水化物酸性比硫酸强 | |
| D. | 磷的氢化物受热时不如氮的氢化物和硫的氢化物稳定 |
1.下列解释实验事实的离子方程式不正确的是( )
| A. | 用烧碱溶液吸收NO2:2NO2+2OH-=NO3-+NO2-+H2O | |
| B. | 用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | 明矾溶液与过量氨水反应:Al3++3NH3.H2O=Al(OH)3↓+3NH4+ | |
| D. | 酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |
8.下面关于钠和钠的化合物描述正确的是( )
| A. | Na2O和Na2O2中阴阳离子个数比都为1:2 | |
| B. | 钠离子和钠原子都具有较强的还原性 | |
| C. | 钠能把钛锆等金属从它们的盐溶液中还原出来 | |
| D. | NaHCO3的热稳定性强于Na2CO3 |
18.下列物质的晶体,按其熔点由高到低的排列顺序正确的是( )
| A. | NaCl SiO2 CO2 | B. | NaCl CO2 SiO2 | ||
| C. | CO2 NaCl SiO2 | D. | SiO2 NaCl CO2 |