题目内容
1.已知铜在常温下能被稀HNO3溶解,反应为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O(1)请将上述反应改写成离子方程式3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
(2)HNO3没有全部参加氧化还原反应,被还原的HNO3占总HNO3的25%,若反应中生成1molNO,则反应中转移3NA个e-,消耗Cu96g.
(3)把6molCu粉投入含8molHNO3和2molH2SO4的稀溶液中,则标准状况下放出的气体的物质的量为3mol.
分析 (1)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,铜、一氧化氮、水在离子反应中保留化学式;
(2)根据方程可知,参加反应的8mol硝酸中,被还原的硝酸的物质的量为2mol,根据化合价变化判断转移电子数;根据方程式计算铜的质量;
(3)先计算氢离子的物质的量,再根据溶液中发生3Cu+8H++2NO3?=3Cu2++2NO↑+4H2O,判断过量,将不足的代入离子反应方程式来计算.
解答 解:(1)铜、一氧化氮、水在离子反应中保留化学式,硝酸在水中电离出氢离子和硝酸根离子,其离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)在氧化还原反应中,化合价降低的是氧化剂,发生的是还原反应,根据方程可知,参加反应的8mol硝酸中,被还原的硝酸的物质的量为2mol,所以被还原的HNO3占总HNO3的25%;由HNO3生成NO,氮元素的化合价从+5价降低到+2价,转移3个电子,所以生成1molNO转移3mol,即3NA个电子;根据反应方程式可知生成1molNO,消耗1.5mol铜,所以铜的质量为m=nM=1.5mol×64g/mol=96g,
故答案为:25;3NA;96;
(3)n(Cu)=6mol,n(NO3-)=8mol,n(H+)=8mol+2×2mol=12mol,
由3Cu+8H++2NO3?=3Cu2++2NO↑+4H2O可知,
6molCu反应需要消耗4molNO3?,消耗16molH+,显然H+不足,
设放出的气体的物质的量为x,则
3Cu+8H++2NO3?=3Cu2++2NO↑+4H2O
8 2
12mol x
82=12molx82=12molx,解得x=3mol,
故答案为:3.
点评 本题考查氧化还原反应的计算,为高频考点,把握离子的物质的量及判断过量、反应中元素的化合价变化是解答本题的关键,并学会利用离子反应来分析解答问题,侧重分析与计算能力的考查,题目难度不大.

| A. | 金属钠高温还原CO2,制人工金刚石膜或粉 | |
| B. | 汽车气囊中用氧化铁除去NaN3受撞击时分解生成的钠 | |
| C. | 隔绝空气条件下加热金属钠与NaNO2反应制取Na2O | |
| D. | 将4.6 g钠与1.6g硫粉迅速混合起来,并放在石棉网上加热 |
| A. | 乙烯的实验式:C2H4 | B. | 乙炔的电子式: | ||
| C. | 甲酸甲酯的结构简式:C2H4O | D. | 氢氧根电子式: |
| A. | NA个H2SO4分子的总质量就是H2SO4的摩尔质量 | |
| B. | 将40 g烧碱溶于水得溶液甲,再向甲中通入1 mol HCl得溶液乙(假设过程中溶液体积不变),则在相同温度下,甲和乙的导电能力一样 | |
| C. | 1 L 0.1 mol/L HF溶液中含有的离子总数约为0.2 NA | |
| D. | 标况下22.4 L SO3溶解于水并稀释为1 L后,溶液中c(H+)=2 mol/L |
(1)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C4H4ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②据上表数据,请你判断下列反应不能成立的是D(填编号)
A、CH3COOH+Na2CO3═NaHCO3+CH3COONa
B、CH3COOH+NaCN═CH4COONa+HCN
C、CO2+H2O+NaClO═NaHCO3+HClO
D、CO2+H2O+2C4H5ONa═Na2CO3+2C8H5OH
③要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-═CO2+Cl-+HClO.
(2)已知温下Cu(OH)2的Ksp=2×10-20,又知常温下某CuSO4溶液里c(Cu2+)=0.02mol•L-1.如果要生成Cu(OH)2,则应调整溶液pH大于5.
(3)已知可逆反应FeO(g)+CO(g)?Fe(g)+CO2(g)是炼铁工业中一个重要反应,某温度与平衡常数K的关系如下表:
| T(K) | 933 | 1100 |
| K | 0.68 | 0.40 |
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的密度减小(选填“增大”“碱小”或“不变”):当n(CO2)n(CO)=0.5,混合气体平均相对分子质量为33.3.
| A. | 红热的铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 | |
| B. | 将SO2气体通入澄清石灰水中,石灰水变浑浊,继续通入SO2,浑浊不消失 | |
| C. | 点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰 | |
| D. | 钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 |
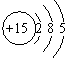
| A. | 磷元素位于元素周期表的第三周期、第ⅤA族 | |
| B. | 磷原子不如氮原子和硫原子的得电子能力强 | |
| C. | 磷的最高价氧化物对应水化物酸性比硫酸强 | |
| D. | 磷的氢化物受热时不如氮的氢化物和硫的氢化物稳定 |

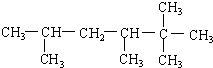 2,2,3,5-四甲基己烷
2,2,3,5-四甲基己烷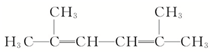 2,5-二甲基-2,4-己二烯.
2,5-二甲基-2,4-己二烯.

 ;
; 、
、 .
.