题目内容
16.A、B、C、D、E是位于短周期的主族元素.已知:①热稳定性:HmD>HmC;②Cm-、E(m-1)-具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的氧化物既可以与强酸反应,又可以与强碱反应;④A与B质子数之和是D质子数的3倍.依据上述信息用相应的化学用语回答下列问题:(1)写出下列元素名称:B钠、E、氯.
(2)C元素在元素周期表中的位置第三周期ⅥA族;A、B、C、D离子半径由大到小的顺序为S2->O2->Na+>Al3+.
(3)Cm-、E(m-1)-的还原性强弱顺序为:S2->Cl-,(用离子符号表示)能证明其还原性强弱的离子方程式为Cl2+S2-=2Cl-+S↓.
(4)将E的单质通入A与D形成的化合物的水溶液中,如果氧化剂与还原剂物质的量之比为5:1,则反应的离子方程式为:3Cl2+6OH-=5Cl-+ClO3-+H2O.
(5)在A、B、C、E单质中,符合下列转化关系的是Na、S(填元素符号).

分析 短周期元素中,A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,则A处于IA族,B的氧化物既可以与强酸反应,又可以与强碱反应,则B为Al、A为Na;A与B质子数之和是D质子数的3倍,则D的质子数为11+13311+133=8,故D为O元素;由①热稳定性:HmD>HmC,则C、D处于同一主族,且D的非金属性更强,故C为硫元素,m=2;根据②Cm-、E(m-1)-具有相同的电子层结构,则E为Cl元素,以此解答该题.
解答 解:短周期元素中,A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,则A处于IA族,B的氧化物既可以与强酸反应,又可以与强碱反应,则B为Al、A为Na;A与B质子数之和是D质子数的3倍,则D的质子数为11+13311+133=8,故D为O元素;由①热稳定性:HmD>HmC,则C、D处于同一主族,且D的非金属性更强,故C为硫元素,m=2;根据②Cm-、E(m-1)-具有相同的电子层结构,则E为Cl元素.
(1)由上述分析可知,A是钠元素、E是氯元素,故答案为:钠;氯;
(2)C为硫元素,处于周期表中第三周期ⅥA族,电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->O2->Na+>Al3+,
故答案为:第三周期ⅥA族;S2->O2->Na+>Al3+;
(3)元素的非金属性越强,其简单阴离子的还原性越弱,S元素的非金属性小于Cl元素,所以还原性强弱顺序为S2->Cl-,氯气能氧化硫离子生成硫单质,反应方程式为Cl2+S2-=2Cl-+S↓,
故答案为:S2->Cl-;Cl2+S2-=2Cl-+S↓;
(4)E是氯气,A与D形成的化合物的水溶液是NaOH,氧化剂与还原剂物质的量之比为5:1,由电子转移守恒可知,氧化产物为KClO3,离子反应方程式为:3Cl2+6OH-=5Cl-+ClO3-+H2O,
故答案为:3Cl2+6OH-=5Cl-+ClO3-+H2O;
(5)A、B、C、E单质分别是Na、Al、S、Cl2,根据单质能连续被氧气氧化,其氧化物2能与水反应生成,符合条件的是Na和S,故答案为:Na、S.
点评 本题考查位置结构性质的关系及应用、常用化学用语、元素化合物性质等,题目难度较大,正确推断元素的种类为解答该题的关键.

 名校课堂系列答案
名校课堂系列答案| A. | 用金属钠除去乙醇中混有的少量水 | |
| B. | 用湿润的蓝色石蕊试纸检验NH3 | |
| C. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| D. | 滴加数滴硫酸锌来加快铁与稀硫酸的反应 |
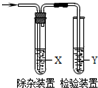 用下列方法制备乙烯并用如图所示装置检验乙烯时不需要除杂的是( )
用下列方法制备乙烯并用如图所示装置检验乙烯时不需要除杂的是( )| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | 水 | Br2的CCl4溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | 水 | KMnO4酸性溶液 |
| C | C2H5OH与浓H2SO4 | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4 | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在涂料中尽量用液态有机物代替水作溶剂以减少环境污染 | |
| B. | 世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济 | |
| C. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
| A. | 金属钠高温还原CO2,制人工金刚石膜或粉 | |
| B. | 汽车气囊中用氧化铁除去NaN3受撞击时分解生成的钠 | |
| C. | 隔绝空气条件下加热金属钠与NaNO2反应制取Na2O | |
| D. | 将4.6 g钠与1.6g硫粉迅速混合起来,并放在石棉网上加热 |
| A. | 53和55 | B. | 131和137 | C. | 78和82 | D. | 76和79 |
| A. | 若升高温度,X(g)的浓度增大,则正反应为吸热反应 | |
| B. | 若容器体积不变,在平衡混合物中加入少量Z(s),则平衡向左移动 | |
| C. | 压强变化对该平衡没有影响 | |
| D. | 若容器体积不变,加入氦气平衡不移动 |
| A. | 聚乙烯可发生加成反应 | |
| B. | 乙烯和甲烷可用酸性高锰酸钾溶液鉴别 | |
| C. | 乙烯和苯都能与溴水反应 | |
| D. | 乙烯和乙烷都能发生加成反应 |
(1)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C4H4ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②据上表数据,请你判断下列反应不能成立的是D(填编号)
A、CH3COOH+Na2CO3═NaHCO3+CH3COONa
B、CH3COOH+NaCN═CH4COONa+HCN
C、CO2+H2O+NaClO═NaHCO3+HClO
D、CO2+H2O+2C4H5ONa═Na2CO3+2C8H5OH
③要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-═CO2+Cl-+HClO.
(2)已知温下Cu(OH)2的Ksp=2×10-20,又知常温下某CuSO4溶液里c(Cu2+)=0.02mol•L-1.如果要生成Cu(OH)2,则应调整溶液pH大于5.
(3)已知可逆反应FeO(g)+CO(g)?Fe(g)+CO2(g)是炼铁工业中一个重要反应,某温度与平衡常数K的关系如下表:
| T(K) | 933 | 1100 |
| K | 0.68 | 0.40 |
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的密度减小(选填“增大”“碱小”或“不变”):当n(CO2)n(CO)=0.5,混合气体平均相对分子质量为33.3.