题目内容
3.火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol.
(2)脱碳.将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H3
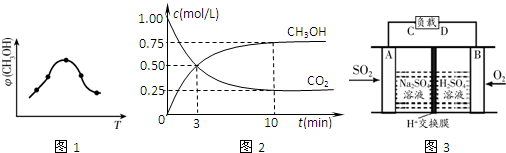
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇的反应的△H3<0(填“>”、“<”或“=”).
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图2所示.试回答:0~10min内,氢气的平均反应速率为0.225mol/(L•min)
mol/(L•min);该温度下,反应的平衡常数的值为$\frac{16}{3}$;第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时CH3OH(g)的体积分数变大(填“变大”、“减少”或“不变”).
(3)脱硫.①有学者想利用如图3所示装置用原电池原理将SO2转化为重要的化工原料,A、B是惰性电极.则导线中电子移动方向为由A到C(用A、C表示),A极的电极反应式为SO2-2e-+2H2O=4H++SO42-.
②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥.硫酸铵和硝酸铵的水溶液pH<7,其原因用离子方程式表示为NH4++H2O═NH3•H2O+H+;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)+c(H+)<c(NO3-)+c(OH-)(填写“>”“=”或“<”).
分析 (1)根据盖斯定律和热化学方程式的意义和书写方法,(①+②)×$\frac{1}{2}$得到热化学方程式;
(2)①图象分析,甲醇含量随温度变化的曲线特征,开始反应进行,平衡后,升温平衡逆向进行,根据温度对化学平衡移动的影响知识来回答;
②三段式来计算平衡浓度,根据化学反应速率v=$\frac{△c}{△t}$以及平衡常数的表达式计算,0~10min内,二氧化碳的平均反应速率=$\frac{1.0mol/L-0.25mol/L}{10min}$=0.075mol/(L•min),所以氢气的反应速率是3×0.075mol/(L•min)=0.225mol/(L•min),
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
初始浓度:1 3 0 0
变化浓度:0.75 2.25 0.75 0.75
平衡浓度:0.25 0.75 0.75 0.75
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;并根据压强对化学平衡移动的影响知识来回答;
(3)①SO2与O2反应生成SO3,SO3再与水化合生成硫酸,根据硫酸的出口判断正负极,负极发生氧化反应,正极发生还原反应,原电池放电时,电子由负极流向正极;
②溶液中铵根离子水解显示酸性,硝酸铵溶液中滴加适量的NaOH溶液溶液的pH=7,则氢离子和氢氧根离子浓度相等,根据电荷守恒来计算.
解答 解:(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
由盖斯定律(①+②)×$\frac{1}{2}$得到热化学方程式为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=$\frac{1}{2}$(-574kJ•mol-1-1160kJ•mol-1)=-867 kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol;
(2)①根据图象分析知道:温度升高,甲醇的体积分数φ(CH3OH)减小,平衡逆向移动,所以反应是放热的,即△H<0,故答案为:<;
②0~10min内,二氧化碳的平均反应速率=$\frac{1.0mol/L-0.25mol/L}{10min}$=0.075mol/(L•min),所以氢气的反应速率是3×0.075mol/(L•min)=0.225mol/(L•min),
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
初始浓度:1 3 0 0
变化浓度:0.75 2.25 0.75 0.75
平衡浓度:0.25 0.75 0.75 0.75
所以平衡常数K=$\frac{0.7{5}^{2}}{0.25×0.7{5}^{3}}$=$\frac{16}{3}$向该容器中再充入1mol CO2和3mol H2,会使得压强增大,平衡正向移动,所以再次达到平衡时CH3OH(g)的体积分数变大,
故答案为:0.225;$\frac{16}{3}$;变大;
(3)①该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,则A为负极,A电极发生的反应为:SO2-2e-+2 H2O=4H++SO42-;原电池放电时,电流由正极流向负极,电子带负电荷,流动方向与电流方向相反,即由A流向C,
故答案为:由A到C;SO2-2e-+2 H2O=4 H++SO42-;
②硫酸铵和硝酸铵的水溶液的pH<7,其原因是溶液中铵根离子水解显示酸性,即NH4++H2O═NH3•H2O+H+,硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)+c(H+)+c(NH4+)=c(NO3-)+c(OH-),所以c(Na+)+c(H+)<c(NO3-)+c(OH-),
故答案为:NH4++H2O═NH3•H2O+H+;<.
点评 本题涉及化学反应中的能量变化以及化学平衡知识的综合计算知识,属于综合知识的考查,难度中等.

| A. | 二氧化硫使纸浆变白 | B. | 氯水使有色布条褪色 | ||
| C. | 活性炭使红墨水褪色 | D. | 漂白粉使某些染料褪色 |
| A. | 因为H-F的键能大于H-CI,所以HF的沸点高于HCI | |
| B. | 因为HCIO4比HCIO中的氯元素的化合价高,所以HCIO4的氧化性强于HCIO | |
| C. | 因为N元素的非金属性比P元素强,所以NH3的稳定性强于PH3 | |
| D. | 因为Fe的还原性强于Cu,所以Cu2+的氧化性强于Fe3+ |
| A. |  装置:石油的分馏 | |
| B. |  装置:测定中和热 | |
| C. |  装置:将浓氨水滴加到生石灰中制取氨气 | |
| D. | 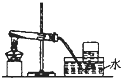 装置:加热氯化铵和消石灰混合物,制取并收集氨气 |
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | 10min内,T1时CH4的化学反应速率比T2时小 | |
| B. | T1<T2 | |
| C. | 平衡常数:K(T1)<K(T2) | |
| D. | a<0 |
| A. | 非金属性X>Y>Z | |
| B. | 含氧酸的酸性H3ZO4>H2YO4>HXO4 | |
| C. | 元素的负化合价的绝对值按X、Y、Z变小 | |
| D. | 原子半径:X>Y>Z |
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子的电子层数比B原子的电子层数多 | |
| C. | 1mol A从酸中置换H+生成的H2比1mol B从酸中置换H+生成的H2多 | |
| D. | 常温时,A能从水中置换出氢,而B不能 |
| A. | 先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在 | |
| B. | 先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在 | |
| C. | 先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在 | |
| D. | 先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存 |