题目内容
13.工业合成氨的反应:N2+3H2?2NH3是一个可逆反应,应条件是高温、高压,并且需要合适的催化剂.已知形成1 mol H-H键、1 mol N-H键、1mol N三N键放出的能量分别为436 kJ、391 kJ、946 kJ.则:(1)若1 mol N2完全反应生成NH3可放出(填“吸收”或“放出”)热量92kJ.
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是合成氨是可逆反应,反应物不能完全转化.
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为0.25mol/L/min.
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是acf.
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度.
分析 (1)△H=反应物键能和-生成物键能和;
(2)合成氨是可逆反应,反应物不能完全转化;
(3)v(NH3)=$\frac{\frac{△n}{V}}{△t}$,$\frac{v({N}_{2})}{v(N{H}_{3})}$=$\frac{1}{2}$,据此求算;
(4)化学平衡状态是正逆反应速率相等,各组分浓度保持不变的状态,反应达到最大限度,据此分析.
解答 解:(1)△H=反应物键能和-生成物键能和,反应N2+3H2?2NH3中△H=(946+3×436-6×391)kJ/mol=-92kJ/mol,所以正反应放热,故答案为:放出;92;
(2)合成氨是可逆反应,反应物不能完全转化,故答案为:合成氨是可逆反应,反应物不能完全转化;
(3)v(NH3)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{10mol}{2L}}{10min}$=0.5mol/(L•min),$\frac{v({N}_{2})}{v(N{H}_{3})}$=$\frac{1}{2}$,所以v(N2)=0.25mol/(L•min),故答案为:0.25;
(4)a.正反应速率和逆反应速率相等,说明反应达到平衡状态,正确;
b.正反应速率最大,逆反应速率为0,是指反应开始时的状态,反应没有达到平衡状态,错误;
c.N2的转化率达到最大值,说明反应达到平衡状态,正确;
d.N2和H2的浓度相等,反应不一定达到平衡状态,错误;
e.N2、H2和NH3的体积分数相等,与平衡状态无关,错误;
f.反应达到最大限度,说明反应达到平衡状态,正确;
故答案为:acf.
点评 本题考查了据键能计算焓变、可逆反应的焓变、化学反应速率的计算、化学平衡状态的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.将标准状况下VL的CO2气体通入500mL4mol/L的NaOH溶液中,下列对所得溶液的叙述不正确的是( )
| A. | 当V<22.4L时,随着CO2气体的通入,溶液中由水电解出的c(H+)逐渐增大 | |
| B. | 当V=22.4L时,所得溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) | |
| C. | 当22.4L<V<44.8L时,所得溶液中一定存在:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 当V=44.8L时,所得溶液中存在:c(OH-)+c(CO32-)=c(H+)+C(H2CO3) |
8.利用太阳光能分解水制氢气是未来解决能源危机的理想方法之一.某研究小组设计了如图所示的循环系统实现光能分解水制氢气.反应过程中所需的电能由太阳光能电池提供,反应体系中I2和Fe3+等可循环使用.则下列有关结论中不正确的是( )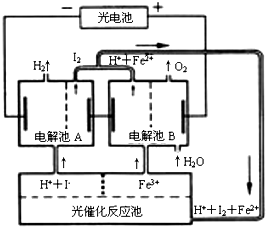

| A. | 外电路中每通过0.2 mol电子,电解池B中就会生成1.12L氧气 | |
| B. | 光催化反应池中离子反应式是:2Fe2++I2$\frac{\underline{\;光照\;}}{\;}$Fe3++2I- | |
| C. | 电解池B中阴极反应式是:Fe3++e-═Fe2+ | |
| D. | 电解池A的阳极反应式是:2I--2e-═I2 |
10.研究发现铜具有独特的杀菌功能,能较好地抑制病菌的生长.现有工业上由辉铜矿石(主要成分Cu2S)的冶炼铜两种方案:
Ⅰ火法炼铜 在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S=6Cu+SO2↑
此方案的尾气可以用表中方法处理
Ⅱ“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强;利用Fe2(SO4)3作氧化剂溶解辉铜矿石,溶液酸性又进一步增强,过滤未溶解完的辉铜矿石,在滤液中加入足量的铁屑,待反应完全后过滤出铜和剩余的铁屑,得溶液Xml(设整个过程中其它杂质不参与反应,不考虑溶液离子水解).其流程如图:
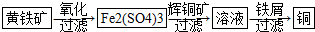
(1)Ⅱ相对于Ⅰ的优点是能大大降低能源消耗,利于减少污染或对贫矿、尾矿的开采更有价值.(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S=6Cu+SO2↑氧化剂是Cu2O、Cu2S
(3)已知CO的燃烧热283.0kJ•mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式S(g)+O2(g)═SO2(g)△H=-574.0kJ•mol-1
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为HSO3-+H2O-2e-=SO42-+3H+.
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式4FeS2+15O2+2H2O $\frac{\underline{\;细菌\;}}{\;}$2Fe2(S04)3+2H2S04
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=$\frac{\frac{42}{75}mol}{v×1{0}^{-3}L}$(可以写表达式)
Ⅰ火法炼铜 在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S=6Cu+SO2↑
此方案的尾气可以用表中方法处理
| 方法1 | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0kJ•mol-1 2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4kJ•mol-1 |
| 方法2 | 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸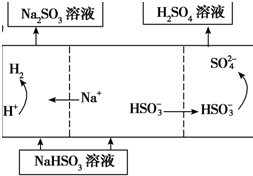 |
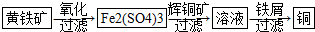
(1)Ⅱ相对于Ⅰ的优点是能大大降低能源消耗,利于减少污染或对贫矿、尾矿的开采更有价值.(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S=6Cu+SO2↑氧化剂是Cu2O、Cu2S
(3)已知CO的燃烧热283.0kJ•mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式S(g)+O2(g)═SO2(g)△H=-574.0kJ•mol-1
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为HSO3-+H2O-2e-=SO42-+3H+.
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式4FeS2+15O2+2H2O $\frac{\underline{\;细菌\;}}{\;}$2Fe2(S04)3+2H2S04
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=$\frac{\frac{42}{75}mol}{v×1{0}^{-3}L}$(可以写表达式)
8.下面是人们对于化学科学的各种常见的认识,其中错误的是( )
| A. | 化学将为环境、能源、资源等问题的解决提供有力保障 | |
| B. | 化学正发展成为一门实验与理论互相结合、互相渗透的科学 | |
| C. | 化学是一门具有极强实用性的自然科学 | |
| D. | 化学是一门纯实验的自然科学,实验是探究化学过程的唯一途径 |
 一种有机化合物的结构简式为:
一种有机化合物的结构简式为: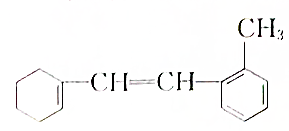 :
:
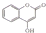 ,常用于制备抗凝血药,可通过下列流程合成:
,常用于制备抗凝血药,可通过下列流程合成:
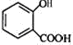 +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$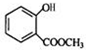 +H2O.
+H2O.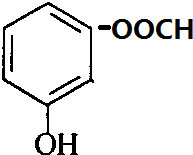 、
、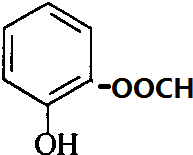 、
、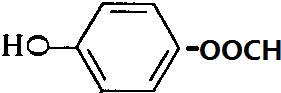 .
.