题目内容
15.同周期的X、Y、Z三种主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )| A. | 非金属性X>Y>Z | |
| B. | 含氧酸的酸性H3ZO4>H2YO4>HXO4 | |
| C. | 元素的负化合价的绝对值按X、Y、Z变小 | |
| D. | 原子半径:X>Y>Z |
分析 同周期的X、Y、Z三主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则X、Y、Z的最高正化合价分别为+7、+6、+5,则原子序数X>Y>Z;
A.同周期自左而右非金属性增强;
B.非金属性越强,最高价含氧酸的酸性越强;
C.最低负化合价=最高正化合价-8;
D.同周期自左而右原子半径减小.
解答 解:同周期的X、Y、Z三主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则X、Y、Z的最高正化合价分别为+7、+6、+5,则原子序数X>Y>Z.
A.同周期自左而右非金属性增强,故非金属性X>Y>Z,故A正确;
B.非金属性X>Y>Z,非金属性越强,最高价含氧酸的酸性越强,故含氧酸的酸性H3ZO4<H2YO4<HXO4,故B错误;
C.X、Y、Z最低负化合价分别为-1、-2、-3,负化合价的绝对值依次增大,故C错误;
D.同周期自左而右原子半径减小,故原子半径X<Y<Z,故D错误,
故选A.
点评 本题考查性质与位置关系、元素周期律等,难度不大,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
10.研究发现铜具有独特的杀菌功能,能较好地抑制病菌的生长.现有工业上由辉铜矿石(主要成分Cu2S)的冶炼铜两种方案:
Ⅰ火法炼铜 在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S=6Cu+SO2↑
此方案的尾气可以用表中方法处理
Ⅱ“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强;利用Fe2(SO4)3作氧化剂溶解辉铜矿石,溶液酸性又进一步增强,过滤未溶解完的辉铜矿石,在滤液中加入足量的铁屑,待反应完全后过滤出铜和剩余的铁屑,得溶液Xml(设整个过程中其它杂质不参与反应,不考虑溶液离子水解).其流程如图:
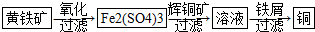
(1)Ⅱ相对于Ⅰ的优点是能大大降低能源消耗,利于减少污染或对贫矿、尾矿的开采更有价值.(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S=6Cu+SO2↑氧化剂是Cu2O、Cu2S
(3)已知CO的燃烧热283.0kJ•mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式S(g)+O2(g)═SO2(g)△H=-574.0kJ•mol-1
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为HSO3-+H2O-2e-=SO42-+3H+.
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式4FeS2+15O2+2H2O $\frac{\underline{\;细菌\;}}{\;}$2Fe2(S04)3+2H2S04
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=$\frac{\frac{42}{75}mol}{v×1{0}^{-3}L}$(可以写表达式)
Ⅰ火法炼铜 在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S=6Cu+SO2↑
此方案的尾气可以用表中方法处理
| 方法1 | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0kJ•mol-1 2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4kJ•mol-1 |
| 方法2 | 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸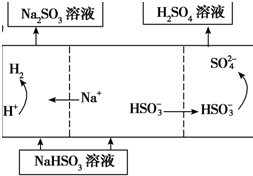 |
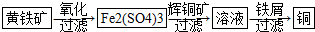
(1)Ⅱ相对于Ⅰ的优点是能大大降低能源消耗,利于减少污染或对贫矿、尾矿的开采更有价值.(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S=6Cu+SO2↑氧化剂是Cu2O、Cu2S
(3)已知CO的燃烧热283.0kJ•mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式S(g)+O2(g)═SO2(g)△H=-574.0kJ•mol-1
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为HSO3-+H2O-2e-=SO42-+3H+.
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式4FeS2+15O2+2H2O $\frac{\underline{\;细菌\;}}{\;}$2Fe2(S04)3+2H2S04
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=$\frac{\frac{42}{75}mol}{v×1{0}^{-3}L}$(可以写表达式)
4.下列现象与电化学腐蚀无关的是( )
| A. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 | |
| B. | 生铁比软铁芯(几乎是纯铁)容易生锈 | |
| C. | 铁质器件附有铜质配件,接触处容易生铁锈 | |
| D. | 银质奖牌放置久了表面变暗 |
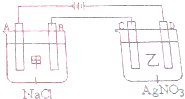
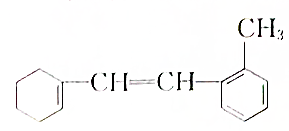 :
:
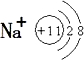 ;B与空气反应的化学方程式2NO+O2=2NO2.
;B与空气反应的化学方程式2NO+O2=2NO2.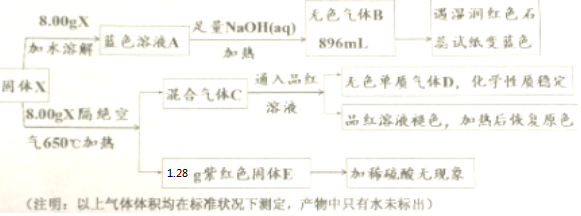
 ;气体D的结构式
;气体D的结构式 .
.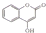 ,常用于制备抗凝血药,可通过下列流程合成:
,常用于制备抗凝血药,可通过下列流程合成:
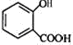 +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$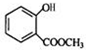 +H2O.
+H2O.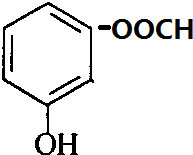 、
、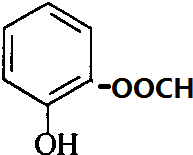 、
、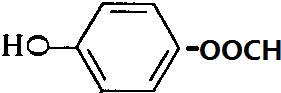 .
.