题目内容
15.10mL某气态烃与过量氧气混合,完全燃烧后再恢复到室温,混合气体的体积减少25mL,剩余气体再通过苛性钠溶液,体积又减少了20mL,则该气态烃的分子式为( )| A. | CH4 | B. | C2H6 | C. | C4H8 | D. | C2H4 |
分析 根据气态烃与过量的氧气反应的化学方程式:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,利用差量法计算出有机物分子中的H原子数;再把这些气体通过苛性钠溶液气体体积,又减少了20mL,减少的气体为二氧化碳气体体积,据此可计算出该烃中含有C原子数,从而确定该烃的分子式.
解答 解:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O△V
1 1+$\frac{y}{4}$
10mL 25mL
则:1×25mL=10mL×(1+$\frac{y}{4}$),
解得:y=6,
把反应后的气体通过苛性钠溶液气体体积,又减少了20mL,减少的气体为二氧化碳,
相同条件下气体的体积之比等于物质的量之比,则该烃中含有C原子数为:$\frac{20mL}{10mL}$=2,
所以该有机物分子式为:C2H6,
故选B.
点评 本题考查了有机物分子式的计算,题目难度中等,明确气体减少的原因及组成为解答关键,注意掌握差量法、质量守恒定律在化学计算中的应用方法.

练习册系列答案
相关题目
5. 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g)+H2O (g)?CO2(g)+H2 (g)△H<0
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g)+H2O (g)?CO2(g)+H2 (g)△H<0
(1)在850℃时,CO和H2O浓度变化如图,则 0~4min的平均反应速率
v(CO2)=0.03mol•L-1•min-1
(2)t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
①计算t1℃该反应的平衡常数为 k=0.5,t1℃大于850℃(填“大于”、“小于”或“等于”).判断依据是:正反应为放热反应.
②t1℃时,反应在4min~5min间,平衡向左移动(填“向左”、“向右”或“不移动”),可能的原因是b.
a.增加CO的浓度 b.增加H2的浓度 c.加压 d.使用催化剂.
 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g)+H2O (g)?CO2(g)+H2 (g)△H<0
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g)+H2O (g)?CO2(g)+H2 (g)△H<0(1)在850℃时,CO和H2O浓度变化如图,则 0~4min的平均反应速率
v(CO2)=0.03mol•L-1•min-1
(2)t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②t1℃时,反应在4min~5min间,平衡向左移动(填“向左”、“向右”或“不移动”),可能的原因是b.
a.增加CO的浓度 b.增加H2的浓度 c.加压 d.使用催化剂.
6.有关煤的综合利用如图所示.下列说法正确的是( )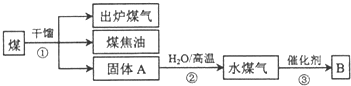

| A. | 煤和水煤气均是二次能源 | |
| B. | 煤中含有苯、甲苯、二甲苯等有机物 | |
| C. | ①是将煤在空气中加强热使其分解的过程 | |
| D. | B为甲醇或乙酸时,原子利用率均达到100% |
10.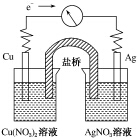 将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )
 将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )| A. | KNO3盐桥中的K+移向Cu(NO3)2溶液 | |
| B. | Cu作负极,发生还原反应 | |
| C. | 电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液 | |
| D. | 工作一段时间后,AgNO3溶液中c(Ag+)减小 |
4.下列实验现象描述正确的是( )
| A. | 二氧化碳气体通入无色酚酞溶液,溶液变红色 | |
| B. | 细铁丝在氧气里剧烈燃烧,火星四射 | |
| C. | 点燃棉线闻到一股烧焦的羽毛味 | |
| D. | 打开浓盐酸试剂瓶的瓶塞,瓶口上方出现大量白烟 |
5.下列说法正确的是( )
| A. | 把SO2通入酸性高锰酸钾溶液,即可验证SO2的漂白性 | |
| B. | 无论是在0.1mol•L-1的CH3COOH溶液中加水稀释,还是加入少量CH3COONa晶体,都会引起溶液的导电能力减弱 | |
| C. | 实验室需用480mL 0.1mol•L-1硫酸铜溶液,应称取12.5g胆矾晶体,并用500mL容量瓶定容配制 | |
| D. | 硫酸亚铁铵晶体中NH4+的检验操作为:取适量样品置于试管中加水溶解,滴加少量稀氢氧化钠溶液,并将湿润的红色石蕊试纸靠近试管口,试纸变蓝则存在NH4+,反之则不存在NH4+ |