题目内容
7.写出下列反应的离子方程式(1)向NaOH溶液中滴加AlCl3溶液Al3++4OH-═AlO2-+2H2O.
(2)把金属铝加到NaOH溶液中2Al+2H2O+2OH-═2AlO2-+3H2↑.
(3)向AlCl3溶液中滴加氨水至过量Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)向NaAlO2 溶液中滴加盐酸AlO2-+H++H2O═Al(OH)3↓.
(5)把金属钠加到CuSO4溶液中2Na+2H2O+Cu2+=Cu(OH)2↓+H2↑+2Na+.
分析 (1)NaOH过量,反应生成偏铝酸钠和氯化钠;
(2)反应生成偏铝酸钠和氢气;
(3)反应生成氢氧化铝和氯化铵;
(4)盐酸少量,生成氢氧化铝和氯化钠;
(5)反应生成硫酸钠、氢氧化铜、氢气.
解答 解:(1)NaOH过量,反应生成偏铝酸钠和氯化钠,离子反应为Al3++4OH-═AlO2-+2H2O,故答案为:Al3++4OH-═AlO2-+2H2O;
(2)反应生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;
(3)反应生成氢氧化铝和氯化铵,离子反应为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(4)盐酸少量,生成氢氧化铝和氯化钠,离子反应为AlO2-+H++H2O═Al(OH)3↓,故答案为:AlO2-+H++H2O═Al(OH)3↓;
(5)反应生成硫酸钠、氢氧化铜、氢气,离子反应为2Na+2H2O+Cu2+=Cu(OH)2↓+H2↑+2Na+,故答案为:2Na+2H2O+Cu2+=Cu(OH)2↓+H2↑+2Na+.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应方程式书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
17.在三个密闭容器中分别充入N2、H2、HCl三种气体,当它们的温度和密度都相同时,这三种气体的压强(p),从大到小的顺序是( )
| A. | p(N2)>p(H2)>p(HCl) | B. | p(HCl)>p(N2)>p(H2) | C. | p(H2)>p(HCl)>p(N2) | D. | p(H2)>p(N2)>p(HCl) |
15.10mL某气态烃与过量氧气混合,完全燃烧后再恢复到室温,混合气体的体积减少25mL,剩余气体再通过苛性钠溶液,体积又减少了20mL,则该气态烃的分子式为( )
| A. | CH4 | B. | C2H6 | C. | C4H8 | D. | C2H4 |
2.某河道两旁有甲乙两厂.它们排放的工业废水中(均无沉淀),共含K+、Ag+、Fe3+、C1-、OH-、NO3- 六种离子.甲厂的废水明显呈碱性,请问乙厂的废水中含有几种离子?( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
12.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,2.24 L 水中分子的数目为0.1 NA | |
| B. | 0.1 mol•L-1氯化铵溶液中含有氯离子的数目为0.1 NA | |
| C. | 常温下,1.7 g氨气中含有电子数目为1.0 NA | |
| D. | 10 g氖气所含原子数为NA |
19.下列有关氯气的说法中,错误的是( )
| A. | 氯气是有毒的气体 | |
| B. | 氯气可以与水反应生成有漂白作用的HClO | |
| C. | 氯气可以与氢氧化钠反应用于尾气的处理 | |
| D. | 实验室用加热分解KClO3的方法制取Cl2 |
17.0.10mol/L的NaAlO2溶液中,离子浓度最小的是( )
| A. | Na+ | B. | H+ | C. | AlO2- | D. | OH- |

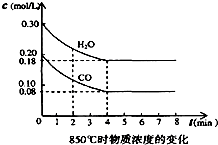 某可逆反应的平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$,恒容时,温度升高H2浓度减小.试回答下列问题:
某可逆反应的平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$,恒容时,温度升高H2浓度减小.试回答下列问题: