题目内容
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,一种生产NaClO2的工艺如下:

己知:①ClO2是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。回答下列问题:
(1)最近科学家又在“反应”步骤的基础上研究出用H2C2O4代替SO2制备ClO2的新方法,该方法的化学方程式为___,该新方法最突出的优点是___。
(2)获得产品NaClO2的“操作”包括以下步骤:
①减压,55℃蒸发结晶;②趁热过滤;③___;④低于60℃干燥,得到产品。
(3)为了测定产品NaClO2的纯度,取上述所得产品12.5g溶于水配成1L溶液,取出10.00mL溶液于锥形瓶中,再加入足量酸化的KI溶势、充分反应后(ClO2-被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.25mol·L-1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00mL,试计算产品NaClO2的纯度___。(提示:2Na2S2O3+I2=Na2S4O6+2Nal)
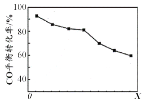
(4)NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒。经测定25℃各含氯微粒浓度随pH的变化情况如图所示(Cl-没有画出)。

①酸性条件下NaClO2溶液中存在的Cl-原因是___(用离子方程式解释)。
②pH=5时,NaClO2溶液中ClO2、HClO2、ClO2-、Cl-四种含氯微粒的浓度由大到小的顺序是___。
【答案】2NaClO3 +H2C2O4+H2SO4 = 2ClO2↑+CO2↑+2H2O 反应中生成的CO2对ClO2起到了稀释作用,提高了生产的安全性能 用38℃—60℃的温水洗涤 90.5% 5ClO2-+ 4H+ =4ClO2 + Cl- + 2H2O c(HClO2) > c(ClO2-) > c(ClO2) > c(Cl-)
【解析】
⑴根据氧化还原反应原理写出新方法制备,由于浓度较大会发生爆炸,因此新方法中二氧化碳对ClO2有稀释作用,降低了浓度,避免安全事故。
⑵由于NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,因此避免低于用38℃以下的水,且不能高于60℃的温水洗涤。
⑶根据方程式建立NaClO2与Na2S2O3关系,列出方程,计算12.5g中NaClO2的物质的量,再计算纯度。
⑷由于ClO2-自身发生氧化还原,根据氧化还原反应原理写出离子方程式,再根据图像得出微粒的浓度大小,还要根据方程式得出c(ClO2)和c(Cl-)的大小。
⑴根据氧化还原反应原理得出该方法的化学方程式为2NaClO3 +H2C2O4+H2SO4 = 2ClO2↑+CO2↑+2H2O,反应生成了CO2和ClO2,CO2对ClO2起到了稀释作用,提高了生产的安全性能,因此该新方法最突出的优点是反应中生成的CO2对ClO2起到了稀释作用,提高了生产的安全性能,故答案为:2NaClO3 +H2C2O4+H2SO4 = 2ClO2↑+CO2↑+2H2O;反应中生成的CO2对ClO2起到了稀释作用,提高了生产的安全性能。
⑵由于NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,因此用38℃—60℃的温水洗涤,故答案为:用38℃—60℃的温水洗涤。
⑶根据方程式得出关系

![]()
解得x = 0.00125mol,则12.5g样品中NaClO2的物质的量0.00125mol×100 = 0.125 mol,其产品NaClO2的纯度![]() ,故答案为:90.5%。
,故答案为:90.5%。
⑷①酸性条件下NaClO2溶液要发生自身氧化还原反应生成Cl-和ClO2,其用离子方程式为5ClO2-+ 4H+ =4ClO2 + Cl-+ 2H2O,故答案为:5ClO2-+ 4H+ =4ClO2 + Cl-+ 2H2O。
②pH=5时,根据图像可以得出NaClO2溶液中c(HClO2) > c(ClO2-) > c(ClO2),根据第①问在酸性条件下得到ClO2和Cl-的比例关系,c(Cl-) < c(ClO2),因此四种含氯微粒的浓度由大到小的顺序是c(HClO2) > c(ClO2-) > c(ClO2) > c(Cl-)。

【题目】欲测定某HCl溶液的物质的量浓度,可用0.1000mol·L-1NaOH标准溶液进行中和滴定(用酚酞作指示剂)。
请回答下列问题:
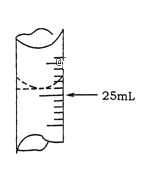
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为 ___________;
(2)乙学生做了三组平行实验,数据记录如下:
实验 序号 | 待测HCl溶液的体积/mL | 0.1000mol·L-1NaOH溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出HCl待测溶液的物质的量浓度为 ________mol·L-1(小数点后保留四位);
(3)滴定时的正确操作是_____________________________________________________。滴定达到终点的现象是_____________________________________________;此时锥形瓶内溶液的pH的范围是________。
(4)下列哪些操作会使测定结果偏高_______________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
【题目】NaHSO3可被过量KIO3氧化,当NaHSO3完全消耗时即有I2析出。某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素。
(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式:____________。
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
① | 10 | 15 | a | 10 | t1 |
② | 10 | 40 | 0 | 10 | t2 |
③ | 10 | b | 0 | 20 | t3 |
表中a=________,b=________。
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。
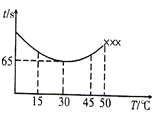
①在30℃下,若溶液变蓝时,I2的物质的量为n mol,则从反应开始至溶液变蓝,IO3-的平均反应速率______mol·L-1·s-1(写出表达式即可,不要化简)。
②根据图像,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:____。
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二:
假设一:反应生成的I2对反应起催化作用;
假设二:_________________________________________;
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定):____。
实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |