题目内容
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(1)从海水中提取镁的流程如图所示:
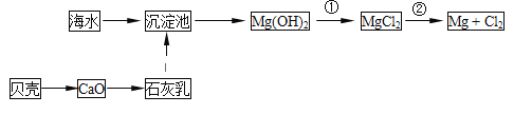
反应①的离子方程式为__;
反应②的化学方程式为__;
(2)海水提取溴流程:
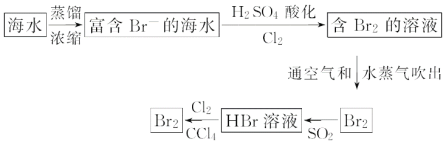
①该流程中涉及发生反应的离子方程式: __; ___;
②该流程中溴元素被氧化又被还原又被氧化的目的是:___;
③从最终溴的四氯化碳溶液中得到液溴,应采取的操作是__。
【答案】Mg(OH)2+2H+=Mg2++2H2O MgCl2(熔融)![]() Mg+Cl2↑ Cl2+2Br- =Br2+2Cl- Br2+SO2+2H2O=4H++2Br- + SO42- 富集溴元素 蒸馏
Mg+Cl2↑ Cl2+2Br- =Br2+2Cl- Br2+SO2+2H2O=4H++2Br- + SO42- 富集溴元素 蒸馏
【解析】
(1)根据对应步骤写出对应的化学方程式或离子方程式;
(2)根据流程分析可知,浓缩海水中通入氧化剂氯气氧化溴离子为单质溴,得到低浓度Br2的溶液,通入热空气或水蒸气吹出Br2,用二氧化硫水溶液吸收得到含HBr的溶液,再用氯气氧化溴离子得到单质溴,用四氯化碳萃取溴单质,再进行蒸馏得到单质溴,据此解答。
(1)反应①是Mg(OH)2与盐酸反应生成氯化镁和水,反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O;反应②是电解熔融MgCl2,反应的化学方程式为:MgCl2(熔融)![]() Mg+Cl2↑;
Mg+Cl2↑;
故答案为:Mg(OH)2+2H+=Mg2++2H2O;MgCl2(熔融)![]() Mg+Cl2↑;
Mg+Cl2↑;
(2)①根据流程分析可知,浓缩海水中通入氧化剂氯气氧化溴离子为单质溴,得到低浓度Br2的溶液,通入热空气或水蒸气吹出Br2,用二氧化硫水溶液吸收得到含HBr的溶液,再用氯气氧化溴离子得到单质溴,用四氯化碳萃取溴单质,再进行蒸馏得到单质溴,因此涉及发生的反应包括:氯气氧化溴离子,Br2与SO2、H2O反应生成氢溴酸和硫酸,反应的离子方程式为:Cl2+2Br- =Br2+2Cl-;Br2+SO2+2H2O=4H++2Br- + SO42-;
故答案为:Cl2+2Br- =Br2+2Cl-;Br2+SO2+2H2O=4H++2Br- + SO42-;
②该流程中溴元素被氧化又被还原又被氧化的目的是富集溴元素;
故答案为:富集溴元素;
③溴易溶于四氯化碳,则可用蒸馏的方法从溴的四氯化碳溶液中得到液溴;
故答案为:蒸馏。