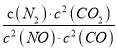题目内容
【题目】一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) ![]() Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A. 若增大压强,则物质Y的转化率减小
B. 将容器体积变为20 L,Z的平衡浓度变为原来的![]()
C. 以X的浓度变化表示的反应速率为0.001 mol/(L·s)
D. 若升高温度,X的体积分数增大,则该反应的ΔH >0
【答案】C
【解析】一定条件下,在容积为10L的密闭容器中,将1molX和1molY进行如下反应:2X(g)+Y(g)![]() Z(g),经60s达到平衡生成0.3mol的Z,则:
Z(g),经60s达到平衡生成0.3mol的Z,则:
2X(g)+Y(g)![]() Z(g)
Z(g)
起始量(mol) 1 1 0
变化量(mol) 0.6 0.3 0.3
平衡量(mol) 0.4 0.7 0.3
A.增大压强,平衡正向移动,则物质Y的转化率增大,故A错误;B.将容器体积变为20L,则体积增大,压强减小,平衡逆向移动,Z的平衡浓度小于原来的![]() ,故B错误;C.以X浓度变化表示的反应速率为
,故B错误;C.以X浓度变化表示的反应速率为 =0.001mol/(Ls),故C正确;D.若升高温度,X的体积分数增大,说明平衡逆向移动,则该反应的△H<0,故D错误;故选C。
=0.001mol/(Ls),故C正确;D.若升高温度,X的体积分数增大,说明平衡逆向移动,则该反应的△H<0,故D错误;故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
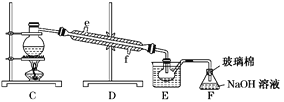
小学生10分钟应用题系列答案【题目】(1)氯化铵的水溶液显弱酸性,其原因为___________________(用离子方程式表示),0.1 molL-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”);
(2)25℃,两种酸的电离平衡常数如下表。
化学式 | CH3COOH | H2CO3 | HCN | HClO | H2SO3 |
电离常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 5×10-10 | 3.0×10-8 | K1=2×10-2 K2=1×10-7 |
①物质的量浓度均为0.1 mol/L的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由大到小的顺序为__________(用编号填写)。
②根据上表数据判断,下列离子方程式错误的是__________。
A.CO2(过量)+H2O+ClO-=HCO3-+HClO B.SO2(过量)+H2O+ClO-=HSO3-+HClO
C.CO2(少量)+H2O+CN-=HCO3-+HCN D.SO2(少量)+H2O+CN-=HSO3-+HCN
E.SO2(少量)+2CO32-+H2O=SO32-+2HCO3- F.2SO2(过量)+CO32-+H2O=2HSO3-+CO2↑
③0.10 molL-1Na2SO3溶液中离子浓度由大到小的顺序为___________________。
④25℃时,NaCN与HCN的混合溶液,若c(CN-)=c(HCN),则溶液中pH=__________(已知lg2=0.3,lg5=0.7)。
⑤25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中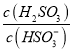 将__________(填“增大”“减小”或“不变”)。
将__________(填“增大”“减小”或“不变”)。