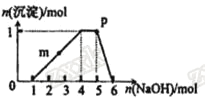
题目内容
【题目】某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是
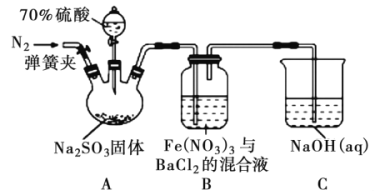
A. 装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO42-
B. 实验室中配制70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C. 三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D. 装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
【答案】A
【解析】
A. 装置A中70%的硫酸与亚硫酸钠反应放出二氧化硫,二氧化硫的水溶液显酸性,在酸性条件下,NO3-能够氧化二氧化硫生成SO42-,从而在B中产生硫酸钡白色沉淀,不能说明Fe3+能将SO2氧化成SO42-,故A错误;
B. 实验室中配制70%的硫酸,需要用量筒量取适当体积的浓硫酸,然后慢慢倒入一定量水中,边倒边搅拌,需要的玻璃仪器有量筒、烧杯、玻璃棒,故B正确;
C. 二氧化硫能够被氧化,为了排除空气中氧气的干扰,在滴加浓硫酸之前,三颈烧瓶中需要通入N2以排尽装置内的空气,故C正确;
D. 二氧化硫在水中的溶解度较大,装置C可能发生倒吸,且气体与液体的反应接触不充分,会导致产生的尾气不能完全吸收,故D正确;
答案选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目