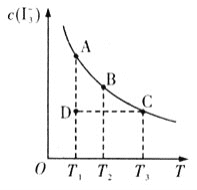
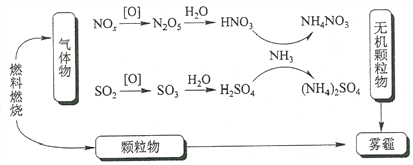
��Ŀ����
����Ŀ�����ⶨijHCl��Һ�����ʵ���Ũ�ȣ�����0.1000mol��L-1NaOH����Һ�����к͵ζ����÷�̪��ָʾ������
��ش��������⣺

(1)����ѧ����ʵ������У���¼�ζ�ǰ�ζ�����Һ�����Ϊ1.10mL���ζ���Һ����ͼ�����ʱ���ı���Һ�����Ϊ ___________��
(2)��ѧ����������ƽ��ʵ�飬���ݼ�¼���£�
ʵ�� ��� | ����HCl��Һ�����/mL | 0.1000mol��L-1NaOH��Һ�����/mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
ѡȡ�����������ݣ������HCl������Һ�����ʵ���Ũ��Ϊ ________mol��L-1��С���������λ����
(3)�ζ�ʱ����ȷ������_____________________________________________________���ζ��ﵽ�յ��������_____________________________________________����ʱ��ƿ����Һ��pH�ķ�Χ��________��
(4)������Щ������ʹ�ⶨ���ƫ��_______________������ţ���
A����ƿ������ˮϴ�������ô���Һ��ϴ
B����ʽ�ζ���������ˮϴ�������ñ�Һ��ϴ
C���ζ�ǰ��ʽ�ζ��ܼ������δ�ų����ζ���������ʧ
D���ζ�ǰ������ȷ���ζ����ӵζ��ܶ���
���𰸡�23.80mL 0.1044 ���ֿ��ƻ��������ֲ���ҡ����ƿ���۾�ע����ƿ����Һ��ɫ�ı仯 ���������һ��NaOH��Һ����ʱ����Һ��ɫǡ������ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ 8.2��10.0 AC
��������
(1)���ݵζ����Һ��ͼ��Һ�������24.90 mL�����ı���Һ����������ζ����IJ
(2)���ݱ������ݣ��ڶ���ʵ��ƫ��������Χ������1��3��ʵ�����ݼ�����������������Һ��ƽ����������� ����HCl������Һ�����ʵ���Ũ�ȡ�
����HCl������Һ�����ʵ���Ũ�ȡ�
(3)�����к͵ζ��Ĺ淶�����ش𣻵�����������������ȫ��Ӧʱ���ﵽ�ζ��յ㣬�ζ������У���ҺpH���ߣ�ָʾ����̪�ı�ɫ��Χ��8.2��10.0��
(4)���� ������
������
(1) �ζ�ǰ�ζ�����Һ�����Ϊ1.10mL���ζ���Һ�������24.90 mL����ʱ���ı���Һ�����Ϊ24.90 mL-1.10mL= 23.80mL��
(2)���ݱ������ݣ��ڶ���ʵ��ƫ��������Χ�� 1��3����ʵ����������������Һ��ƽ�����Ϊ![]() =26.10mL��
=26.10mL��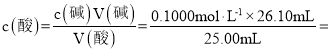 0.1044 mol��L-1��
0.1044 mol��L-1��
(3)�к͵ζ�ʱ�����ֿ��ƻ��������ֲ���ҡ����ƿ���۾�ע����ƿ����Һ��ɫ�ı仯���ζ������У���ҺpH���ߣ����Եζ��ﵽ�յ�������ǣ����������һ��NaOH��Һʱ����Һ��ɫǡ������ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ��ָʾ����̪�ı�ɫ��Χ��8.2��10.0����ʱ��ƿ����Һ��pH�ķ�Χ��8.2��10.0��
(4) A����ƿ������ˮϴ�������ô���Һ��ϴ���������ʵ������࣬���������������ƫ�ⶨ���ƫ�ߣ���ѡA��
B����ʽ�ζ���������ˮϴ�������ñ�Һ��ϴ����Ӱ�죬�ʲ�ѡB��
C���ζ�ǰ��ʽ�ζ��ܼ������δ�ų����ζ���������ʧ����������������Һ�����ƫ�ⶨ���ƫ�ߣ���ѡC��
D���ζ�ǰ������ȷ���ζ����ӵζ��ܶ���������������Һ�����ƫС���ⶨ���ƫ�ͣ��ʲ�ѡD��

 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д�����Ŀ��ijʵ��С���KSCN�����ʽ���̽�����������ʵ�飺
�Թ����Լ� | ʵ�� | �μ��Լ� | ���� |
KSCN��Һ | �� | i.�ȼ�1 mL 0.1 mol/L FeSO4��Һ ii.�ټ������ữ��KMnO4��Һ | i.���������� ii.�ȱ�죬����ɫ |
�� | iii.�ȵμ�1 mL 0.05 mol/L Fe2(SO4)3��Һ iv.�ٵμ�0.5 mL 0.5 mol/L FeSO4��Һ | iii.��Һ��� iv.��ɫ���Ա�dz |
(1)�������ӷ���ʽ��ʾʵ��I��Һ����ԭ��___________
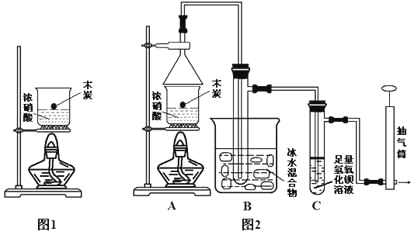
�����ʵ��I�к�ɫ��ȥ��ԭ��С��ͬѧ��Ϊ��SCN������KMnO4����ΪSO42���������ͼʵ��װ��֤ʵ�˲����dz����ġ�
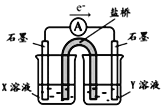
����X��Һ��_____________���������SO42�IJ�����������__________��
(2)���ʵ�������ɫ���Ա�dz����ʵ��С�����Ԥ�⡣
ԭ��٣�������ǿ����ʺ����������Ӽ�����ã�����֮��ǣ��������ǿ��������ЧӦ��������ЧӦ��ʹFe3++SCN![]() [Fe(SCN)]2+ƽ����ϵ�е�Fe3+��SCN��ϳ�[Fe(SCN)]2+�Ļ�����٣���Һ��ɫ��dz��
[Fe(SCN)]2+ƽ����ϵ�е�Fe3+��SCN��ϳ�[Fe(SCN)]2+�Ļ�����٣���Һ��ɫ��dz��
ԭ��ڣ�SCN������Fe2+��Ӧ������ɫ������ӣ���һ��ʹFe3++SCN![]() [Fe(SCN)]2+ƽ�����ƣ���ɫ���Ա�dz��
[Fe(SCN)]2+ƽ�����ƣ���ɫ���Ա�dz��
��֪��Mg2+��SCN����ϣ�����С�����������ʵ�飺
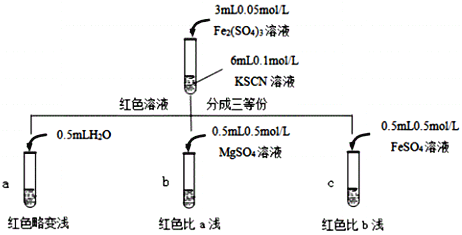
�ɴ��Ʋ⣬ʵ�������ɫ���Ա�dz����ԭ����___________________________��