题目内容
9.表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
| 4 | ② | ④ |
(2)元素④的离子结构示意图为
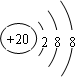 ;
;(3)①、⑧、⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示):Cl->F->Na+
(4)写出④和⑨形成的化合物的电子式:
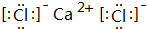
(5)请写出:
(ⅰ)③的单质置换出⑥的单质的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为:NaOH+Al(OH)3=NaAlO2+2H2O
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为:H++OH-=H2O
(ⅳ)①的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O.
分析 由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为P、⑧为F、⑨为Cl、⑩为Ne.
(1)稀有气体最外层为稳定结构,化学性质最不活泼;电负性越大,得电子能力最强;
(2)元素④的离子为Ca2+,质子数为20,核外电子数为18,有3个电子层,各层电子数为2、8、8;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(4)④和⑨形成的化合物为CaCl2,由钙离子与氯离子构成;
(5)(ⅰ)③的单质置换出⑥的单质,为Mg在二氧化碳中燃烧生成MgO与碳;
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物分别为KOH、HPClO4,二者反应生成高氯酸钾与水;
(ⅳ)①的最高价氧化物对应水化物为NaOH,⑤的最高价氧化物为Al2O3,二者反应生成偏铝酸钠与水.
解答 解:由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为P、⑧为F、⑨为Cl、⑩为Ne.
(1)稀有气体Ne原子最外层为稳定结构,化学性质最不活泼;同周期自左而右电负性增大、同主族自上而下电负性减小,故上述元素中F元素电负性最大,故F得电子能力最强,故答案为:⑩;F;
(2)元素④的离子为Ca2+,质子数为20,核外电子数为18,有3个电子层,各层电子数为2、8、8,离子结构示意图为: ,故答案为:
,故答案为: ;
;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:Cl->F->Na+,故答案为:Cl->F->Na+;
(4)④和⑨形成的化合物为CaCl2,由钙离子与氯离子构成,电子式为: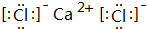 ,故答案为:
,故答案为: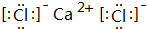 ;
;
(5)(ⅰ)③的单质置换出⑥的单质,为Mg在二氧化碳中燃烧生成MgO与碳,化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应方程式为:NaOH+Al(OH)3=NaAlO2+2H2O,故答案为:NaOH+Al(OH)3=NaAlO2+2H2O;
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物分别为KOH、HPClO4,二者反应生成高氯酸钾与水,反应离子方程式为:H++OH-=H2O,故答案为:H++OH-=H2O;
(ⅳ)①的最高价氧化物对应水化物为NaOH,⑤的最高价氧化物为Al2O3,二者反应生成偏铝酸钠与水,反应方程式为:Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O.
点评 本题考查元素周期表与元素周期律综合应用,难度不大,侧重对化学用语的考查,注意理解掌握元素周期律.

| A. | 1.7g羟基含有的电子数目为NA | |
| B. | 常温常压下,23g由NO2与N2O4组成的混合气体含有的氮原子数目为0.5NA | |
| C. | 标准状况下,6.72L H2O中含有的水分子数目为0.3NA | |
| D. | 1 mol•L-1NaClO溶液中含有的ClO-数目为NA |
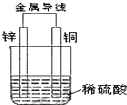
| A. | 铜是阳极,铜片上有气泡产生 | B. | 铜片质量不断减少 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 氢离子在铜片表面被还原 |
| A. | 该温度高于25℃ | |
| B. | 由水电离出来的H+的浓度是1.0×10-10 mol•L-1 | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | 该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性 |
| A. | SiH4 | B. | CH3Cl | C. | P4 | D. | NH4+ |
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙 酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| C | 乙醇(乙酸) | 无 | 分液 |
| D | 甲烷(乙烯) | 溴水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |

 ,其空间构型为正四面体.
,其空间构型为正四面体. .
.