题目内容
18.除去如表物质中所含少量杂质(括号内为杂质),所试剂和分离方法能达到目的是( )| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙 酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| C | 乙醇(乙酸) | 无 | 分液 |
| D | 甲烷(乙烯) | 溴水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溴、三溴苯酚易溶于苯;
B.二者均与NaOH溶液反应;
C.乙醇、乙酸不分层;
D.乙烯与溴水反应,而甲烷不能.
解答 解:A.溴易溶于苯,且生成的三溴苯酚也溶于苯,引入新杂质,不符合除杂原则,故A错误;
B.二者均与NaOH溶液反应,应利用饱和碳酸钠溶液除杂,故B错误;
C.乙醇、乙酸不分层,应利用蒸馏原理除杂,故C错误;
D.乙烯与溴水反应,而甲烷不能,则利用溴水和洗气法可除杂,故D正确.
故选D.
点评 本题考查物质分离、提纯的基本方法和选择,为高频考点,把握物质的性质及常见的混合物分离方法为解答的关键,注意物质性质及分离原理,题目难度不大.

练习册系列答案
相关题目
9.表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题.
(1)在这10种元素中,化学性质最不活泼的元素是⑩(写序号),得电子能力最强的原子是F(用元素符号表示);
(2)元素④的离子结构示意图为 ;
;
(3)①、⑧、⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示):Cl->F->Na+
(4)写出④和⑨形成的化合物的电子式:
(5)请写出:
(ⅰ)③的单质置换出⑥的单质的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为:NaOH+Al(OH)3=NaAlO2+2H2O
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为:H++OH-=H2O
(ⅳ)①的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
| 4 | ② | ④ |
(2)元素④的离子结构示意图为
 ;
;(3)①、⑧、⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示):Cl->F->Na+
(4)写出④和⑨形成的化合物的电子式:

(5)请写出:
(ⅰ)③的单质置换出⑥的单质的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为:NaOH+Al(OH)3=NaAlO2+2H2O
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为:H++OH-=H2O
(ⅳ)①的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O.
3.如图是酸性氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
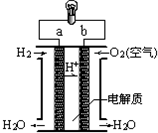

| A. | a极是负极 | |
| B. | 电流由b通过灯泡流向a | |
| C. | 正极的电极反应是:O2+2H2O+4e-═4OH- | |
| D. | 氢氧燃料电池是环保电池 |
10.在铜-锌-硫酸构成的原电池中,当导线中有1mol电子通过时,理论上的两极变化是( )
①锌片溶解32.5g ②锌片增重32.5g ③铜片上析出1gH2 ④铜片上析出1mol H2.
①锌片溶解32.5g ②锌片增重32.5g ③铜片上析出1gH2 ④铜片上析出1mol H2.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
7.1.0L 1.00mol•L-1H2SO4溶液与2.00L 1.00mol•L-1NaOH溶液完全反应,放出114.6kJ热量,则可推算出该条件下酸与碱反应的中和热为( )
| A. | 57.3 kJ•mol-1 | B. | 114.9 kJ•mol-1 | C. | 171.9 kJ•mol-1 | D. | 229.2 kJ•mol-1 |
