题目内容
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 1.7g羟基含有的电子数目为NA | |
| B. | 常温常压下,23g由NO2与N2O4组成的混合气体含有的氮原子数目为0.5NA | |
| C. | 标准状况下,6.72L H2O中含有的水分子数目为0.3NA | |
| D. | 1 mol•L-1NaClO溶液中含有的ClO-数目为NA |
分析 A、求出羟基的物质的量,然后根据1mol羟基含9mol电子来计算;
B、根据NO2与N2O4的最简式均为NO2来计算;
C、标况下,水为液态;
D、溶液体积不明确.
解答 解:A、1.7g羟基的物质的量n=$\frac{1.7g}{17g/mol}$=0.1mol,而1mol羟基含9mol电子,故0.1mol羟基含0.9mol电子,故A错误;
B、NO2与N2O4的最简式均为NO2,故23g混合物中含有的NO2的物质的量n=$\frac{23g}{46g/mol}$=0.5mol,故含有0.5mol氮原子,即0.5NA个,故B正确;
C、标况下,水为液态,故不能根据气体摩尔体积来计算,故C错误;
D、溶液体积不明确,故无法计算溶液中的次氯酸根的个数,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
9.下列实验能达到实验预期的是( )
| 选项 | 实验内容 | 实验目的 |
| A | 向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同条件下溶解度Mg(OH)2>Fe(OH)3 |
| B | 过量的铁粉中加入稀硝酸,充分反应后,滴入KSCN溶液,溶液不呈红色 | 证明稀硝酸不能将铁氧化为Fe3+ |
| C | 向淀粉水解液中加入新制Cu(OH)2,煮沸,没有生成砖红色沉淀 | 淀粉没有水解 |
| D | 向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂) | 滴定其中NaOH含量 |
| A. | A | B. | B | C. | C | D. | D |
10.由短周期元素构成的某离子化合物中,一个阳离子和一个阴离子核外电子数之和为20,且阴、阳离子所带电荷相等.下列说法正确的是( )
| A. | 晶体中阳离子和阴离子数不一定相等 | |
| B. | 晶体中一定只有离子键没有共价键 | |
| C. | 所含元素一定不在同一周期也不在第1周期 | |
| D. | 晶体中阳离子半径一定大于阴离子半径 |
14.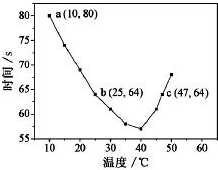 已知NaHSO3溶液在不同温度下均可被过量 KIO3氧化,当 NaHSO3完全消耗即有 I2析出,依据 I2析出所需时间可以求得 NaHSO3的反应速率.将浓度均为 0.020mol•L-1的 NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液 40.0mL 混合,记录 10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
已知NaHSO3溶液在不同温度下均可被过量 KIO3氧化,当 NaHSO3完全消耗即有 I2析出,依据 I2析出所需时间可以求得 NaHSO3的反应速率.将浓度均为 0.020mol•L-1的 NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液 40.0mL 混合,记录 10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
 已知NaHSO3溶液在不同温度下均可被过量 KIO3氧化,当 NaHSO3完全消耗即有 I2析出,依据 I2析出所需时间可以求得 NaHSO3的反应速率.将浓度均为 0.020mol•L-1的 NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液 40.0mL 混合,记录 10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
已知NaHSO3溶液在不同温度下均可被过量 KIO3氧化,当 NaHSO3完全消耗即有 I2析出,依据 I2析出所需时间可以求得 NaHSO3的反应速率.将浓度均为 0.020mol•L-1的 NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液 40.0mL 混合,记录 10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A. | 40℃之前,溶液变蓝的时间随温度的升高而缩短 | |
| B. | 图中a点对应的 NaHSO3反应速率为 5.0×10-5mol•L-1•s-1 | |
| C. | 图中b、c两点对应的 NaHSO3反应速率相等 | |
| D. | 40℃之后,淀粉不宜用作该实验的指示剂 |
4.奠定近代化学基础的学说是( )
| A. | 分子-原子论 | B. | 元素周期律 | C. | 物质不灭定律 | D. | 质量守恒定律 |
11.关于O2、CO2、SO2、H2O2四种物质,下列叙述正确的是( )
| A. | 都有氧分子 | B. | 一个分子中都有两个氧原子 | ||
| C. | 都是氧化物 | D. | 都是化合物 |
9.表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题.
(1)在这10种元素中,化学性质最不活泼的元素是⑩(写序号),得电子能力最强的原子是F(用元素符号表示);
(2)元素④的离子结构示意图为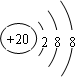 ;
;
(3)①、⑧、⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示):Cl->F->Na+
(4)写出④和⑨形成的化合物的电子式: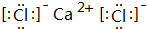
(5)请写出:
(ⅰ)③的单质置换出⑥的单质的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为:NaOH+Al(OH)3=NaAlO2+2H2O
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为:H++OH-=H2O
(ⅳ)①的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
| 4 | ② | ④ |
(2)元素④的离子结构示意图为
 ;
;(3)①、⑧、⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示):Cl->F->Na+
(4)写出④和⑨形成的化合物的电子式:
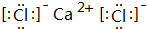
(5)请写出:
(ⅰ)③的单质置换出⑥的单质的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为:NaOH+Al(OH)3=NaAlO2+2H2O
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为:H++OH-=H2O
(ⅳ)①的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O.