题目内容
19.下列叙述中可以说明反应2HI?H2+I2(g)已达平衡状态的是②①单位时间内生成n mol H2的同时生成n mol HI
②一个H-H键断裂的同时有两个H-I键断裂
③百分组成HI=I2%
④反应速率v(H2)=V(I2)=$\frac{1}{2}$v(HI)时.
分析 反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断.
解答 解:①单位时间内生成n mol H2的同时生成2n mol HI时,反应未达到平衡状态,故错误;
②反应过程中有一个H-H键断裂的同时有两个H-I键断裂,说明正逆反应速率相等,证明反应达到平衡状态,故正确;
③各组分多少,与开始加入的物质的量多少有关,与平衡无关,故错误;
④无论反应是否达到平衡状态,反应速率之比都等于其化学计量数之比,所以v(H2)=V(I2)=$\frac{1}{2}$v(HI)不能说明反应达到平衡状态,故错误;
故答案为:②.
点评 本题考查了化学平衡状态的判断,难度不大,注意平衡是各组分浓度不变,正逆反应速率相等是平衡的关键.

练习册系列答案
相关题目
9.表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题.
(1)在这10种元素中,化学性质最不活泼的元素是⑩(写序号),得电子能力最强的原子是F(用元素符号表示);
(2)元素④的离子结构示意图为 ;
;
(3)①、⑧、⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示):Cl->F->Na+
(4)写出④和⑨形成的化合物的电子式:
(5)请写出:
(ⅰ)③的单质置换出⑥的单质的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为:NaOH+Al(OH)3=NaAlO2+2H2O
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为:H++OH-=H2O
(ⅳ)①的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
| 4 | ② | ④ |
(2)元素④的离子结构示意图为
 ;
;(3)①、⑧、⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示):Cl->F->Na+
(4)写出④和⑨形成的化合物的电子式:

(5)请写出:
(ⅰ)③的单质置换出⑥的单质的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为:NaOH+Al(OH)3=NaAlO2+2H2O
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为:H++OH-=H2O
(ⅳ)①的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O.
10.在铜-锌-硫酸构成的原电池中,当导线中有1mol电子通过时,理论上的两极变化是( )
①锌片溶解32.5g ②锌片增重32.5g ③铜片上析出1gH2 ④铜片上析出1mol H2.
①锌片溶解32.5g ②锌片增重32.5g ③铜片上析出1gH2 ④铜片上析出1mol H2.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
7.1.0L 1.00mol•L-1H2SO4溶液与2.00L 1.00mol•L-1NaOH溶液完全反应,放出114.6kJ热量,则可推算出该条件下酸与碱反应的中和热为( )
| A. | 57.3 kJ•mol-1 | B. | 114.9 kJ•mol-1 | C. | 171.9 kJ•mol-1 | D. | 229.2 kJ•mol-1 |
14.下列取代基或微粒中,碳原子都满足最外层为8电子结构的是( )
| A. | 苯 | B. | 乙基(-CH2CH3) | C. | 碳正离子[(CH3)3C+] | D. | 碳烯(:CH2) |
4.下列关于电化学的说法中错误的是( )
| A. | 原电池的负极、电解池的阳极均发生氧化反应 | |
| B. | 原电池将化学能转化为电能,电解池将电能转化为化学能 | |
| C. | 电解水制取H2和O2时,为了增强导电性,可加入NaOH、NaCl、H2SO4 | |
| D. | 利用原电池原理可制备化学电源,利用电解池原理可制备化学物质 |
11. A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素,A元素原子的核外电子数、电子层数和最外层电子数均相等,元素B的一种常见单质可做惰性电极材料,C、D、G三种元素在周期表中的相对位置如图①所示,C、D、F的质子数之和等于E、G的质子数之和.E、F为金属元素,只有G元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、C两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质.它们之间的转化关系如图②所示.
A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素,A元素原子的核外电子数、电子层数和最外层电子数均相等,元素B的一种常见单质可做惰性电极材料,C、D、G三种元素在周期表中的相对位置如图①所示,C、D、F的质子数之和等于E、G的质子数之和.E、F为金属元素,只有G元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、C两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质.它们之间的转化关系如图②所示.
请回答下列问题:
(1)Z的化学式为NO2.乙的结构式为N≡N.
(2)B的最高价氧化物的电子式为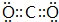 .
.
(3)用电子式表示A元素和E元素形成化合物的过程: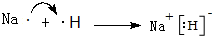 .
.
(4)G的单质与水反应的离子方程式Cl2+H2O?H++Cl-+HClO.
(5)F的单质与E的最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.W空气燃料电池放电时负极反应式为N2H4+4OH--4e-=N2↑+4H2O.
 A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素,A元素原子的核外电子数、电子层数和最外层电子数均相等,元素B的一种常见单质可做惰性电极材料,C、D、G三种元素在周期表中的相对位置如图①所示,C、D、F的质子数之和等于E、G的质子数之和.E、F为金属元素,只有G元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、C两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质.它们之间的转化关系如图②所示.
A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素,A元素原子的核外电子数、电子层数和最外层电子数均相等,元素B的一种常见单质可做惰性电极材料,C、D、G三种元素在周期表中的相对位置如图①所示,C、D、F的质子数之和等于E、G的质子数之和.E、F为金属元素,只有G元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、C两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质.它们之间的转化关系如图②所示.| C | D | |
| G |
(1)Z的化学式为NO2.乙的结构式为N≡N.
(2)B的最高价氧化物的电子式为
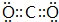 .
.(3)用电子式表示A元素和E元素形成化合物的过程:
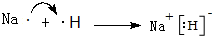 .
.(4)G的单质与水反应的离子方程式Cl2+H2O?H++Cl-+HClO.
(5)F的单质与E的最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.W空气燃料电池放电时负极反应式为N2H4+4OH--4e-=N2↑+4H2O.
2. NaCI是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )
NaCI是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )
 NaCI是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )
NaCI是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )| A. | 常温干燥的Cl2能用钢瓶储存,所以Cl2不与铁反应 | |
| B. | 工业上利用澄清石灰水与Cl2反应来制漂白粉 | |
| C. | 往NaCl溶液中先通足量氨气后,再通入足量CO2才可能析出NaHCO3 | |
| D. | 电解含酚酞的NaCl溶液,由于OH-往阳极移动,故阳极先变红 |