题目内容
20.关于如图所示装置的叙述,正确的是( )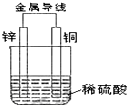
| A. | 铜是阳极,铜片上有气泡产生 | B. | 铜片质量不断减少 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 氢离子在铜片表面被还原 |
分析 锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,铜为正极,发生还原反应,以此解答.
解答 解:锌比铜活泼,形成原电池反应时,锌为负极,Zn失电子发生氧化反应,铜为正极,溶液中氢离子在正极上得电子发生还原反应,铜质量不变,电流从正极Cu流向负极Zn,故ABC错误,D正确;
故选D.
点评 本题考查原电池知识,侧重于学生的分析能力和电化学基础知识的考查,为高考常见题型和高频考点,难度不大.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
10.由短周期元素构成的某离子化合物中,一个阳离子和一个阴离子核外电子数之和为20,且阴、阳离子所带电荷相等.下列说法正确的是( )
| A. | 晶体中阳离子和阴离子数不一定相等 | |
| B. | 晶体中一定只有离子键没有共价键 | |
| C. | 所含元素一定不在同一周期也不在第1周期 | |
| D. | 晶体中阳离子半径一定大于阴离子半径 |
11.关于O2、CO2、SO2、H2O2四种物质,下列叙述正确的是( )
| A. | 都有氧分子 | B. | 一个分子中都有两个氧原子 | ||
| C. | 都是氧化物 | D. | 都是化合物 |
15.向饱和澄清石灰水中加入少量CaC2,充分反应后恢复到原来的温度,所得溶液中( )
| A. | c(Ca2+)、c(OH-)均增大 | |
| B. | 钙离子和氢氧根离子的物质的量均保持不变 | |
| C. | 钙离子和氢氧根离子的物质的量均减小 | |
| D. | c(OH-)增大、c(H+)减小 |
5.下列有机物的命名正确的是( )
| A. | 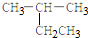 2-乙基乙烷 | B. | 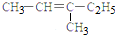 3-甲基-3-戊稀 3-甲基-3-戊稀 | C. | 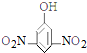 2,4-二硝基苯酚 2,4-二硝基苯酚 | D. |  2,3-丁二醇 |
12.氧是地壳中含量最多的元素.下列含氧物质中,氧元素化合价最高的是( )
| A. | H2O | B. | O3 | C. | H2O2 | D. | HClO |
9.表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题.
(1)在这10种元素中,化学性质最不活泼的元素是⑩(写序号),得电子能力最强的原子是F(用元素符号表示);
(2)元素④的离子结构示意图为 ;
;
(3)①、⑧、⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示):Cl->F->Na+
(4)写出④和⑨形成的化合物的电子式:
(5)请写出:
(ⅰ)③的单质置换出⑥的单质的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为:NaOH+Al(OH)3=NaAlO2+2H2O
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为:H++OH-=H2O
(ⅳ)①的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
| 4 | ② | ④ |
(2)元素④的离子结构示意图为
 ;
;(3)①、⑧、⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示):Cl->F->Na+
(4)写出④和⑨形成的化合物的电子式:

(5)请写出:
(ⅰ)③的单质置换出⑥的单质的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为:NaOH+Al(OH)3=NaAlO2+2H2O
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为:H++OH-=H2O
(ⅳ)①的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O.