题目内容
14.现有短周期元素X、Y、Z、M,周期表中元素X的原子半径最小,Y原子最外层电子数是次外层的3倍,Z的化合物焰色反应为黄色,Y和M同主族.下列说法不正确的是( )| A. | 气态氢化物的稳定性:Y<M | |
| B. | 简单离子半径由大到小的顺序是:M>Y>Z | |
| C. | 化合物Z2Y2 中含有离子键和非极性共价键 | |
| D. | 等浓度的X2M与Z2M的溶液中,水的电离程度:X2M<Z2M |
分析 现有短周期元素X、Y、Z、M,周期表中元素X的原子半径最小,则X为H元素;Y原子最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;Y和M同主族,则M为S元素,Z的化合物焰色反应为黄色,则Z为N.
A.同主族自上而下非金属性增强,非金属性越强,氢化物越稳定;
B.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
C.化合物Na2O2由钠离子与过氧根离子构成,过氧根离子中氧原子之间形成非极性共价键;
D.H2S溶液呈酸性,抑制水的电离,而Na2S的溶液中,硫离子水解,促进水解的电离.
解答 解:现有短周期元素X、Y、Z、M,周期表中元素X的原子半径最小,则X为H元素;Y原子最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;Y和M同主族,则M为S元素,Z的化合物焰色反应为黄色,则Z为Na.
A.非金属性Y(O)>M(S),故氢化物稳定性H2O>H2S,故A错误;
B.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径M(S2-)>Y(O2-)>Z(Na+),故B正确;
C.化合物Na2O2 中含有离子键和非极性共价键,故C正确;
D.H2S溶液中硫化氢电离,溶液呈酸性,抑制水的电离,而Na2S的溶液中,硫离子水解,促进水的电离,故Na2S溶液中水的电离程度更大,故D正确,
故选A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,是对基础知识的综合考查,难度中等,注意掌握微粒半径的比较.

练习册系列答案
相关题目
4.下列变化中:①合成氨,②闪电固氮,③二氧化氮与水反应;按氮元素被氧化、被还原、既被氧化又被还原的顺序排列正确的是( )
| A. | ①②③ | B. | ②①③ | C. | ①③② | D. | ③①② |
2.下列叙述中正确的是( )
| A. | CuSO4溶液、稀豆浆、硅酸都能产生丁达尔效应 | |
| B. | 将NaAlO2溶液蒸干后灼烧,所得固体产物为Al2O3 | |
| C. | 标准状况下,22.4L二氯甲烷中含σ键的数目为2.408×1024 | |
| D. | 室温下,7.0g乙烯和丁烯的混合气体中含有氢原子的数目为6.02×1023 |
9.下列实验中,实验操作、现象及结论都正确的是( )
| 操 作 | 现 象 | 结 论 | |
| A | 向某溶液中滴加BaCl2溶液和稀HNO3 | 产生白色沉淀 | 溶液中一定含有SO42- |
| B | 淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 | 产生红色沉淀 | 淀粉水解可生成葡萄糖 |
| C | 向盛有0.5mol•L-1Fe(NO3)2溶液的试管中加入0.5mol•L-3H2SO4溶液 | 在试管口处现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| D | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液呈紫色 | 原溶液中有I- |
| A. | A | B. | B | C. | C | D. | D |
19.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 在反应中消耗0.1molCl2,转移的电子数一定为0.2NA | |
| B. | 15gCH3+(碳正离子)中含有的电子数为10NA | |
| C. | 标准状况下,0.5mol氦气含有的电子数为NA | |
| D. | 0.1L 2mol•L-1的(NH4)2S溶液中含有的S2-数目为0.2NA |
3.下表中a、b、c表示相应仪器中加人的试剂,可用如图装置制取、净化、收集的气体是( )
| 编号 | 气体 | a | b | c | 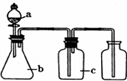 |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 | |
| B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
| C | NO | 稀硝酸 | 铜屑 | H2O | |
| D | Cl2 | 浓盐酸 | 二氧化锰 | 饱和NaCl溶液 |
| A. | A | B. | B | C. | C | D. | D |

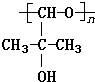
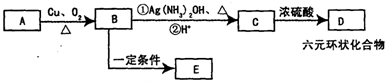
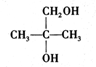 ,B中的官能团名称是醛基、羟基.
,B中的官能团名称是醛基、羟基.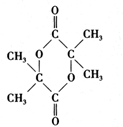 .
. .
.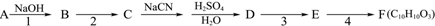
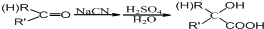
 .
.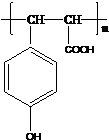 .
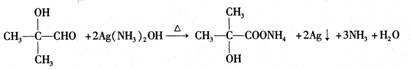
.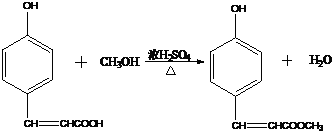 ,反应类型酯化反应.
,反应类型酯化反应. )
)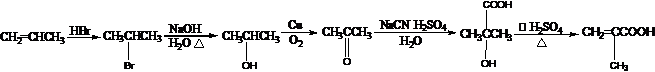 .
.