题目内容
5.根据如图回答问题.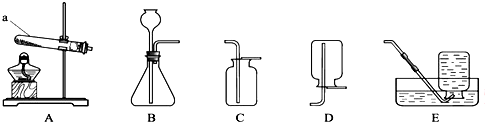
(1)仪器a的名称是试管.
(2)实验室制取二氧化碳应选用的收集装置是C(填装置代号),将燃着的木条接近集气瓶口,若观察到木条熄灭,说明二氧化碳已收集满.
(3)若用装置A、C制取氧气,反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
分析 (1)a为试管;
(2)二氧化碳密度比空气大,用向上排空法收集,结合二氧化碳不支持燃烧的性质检验;
(3)若用装置A、C制取氧气,反应的特点为固体+固体$\stackrel{△}{→}$气体的特点.
解答 解:(1)由装置图可知a为试管,故答案为:试管;
(2)二氧化碳密度比空气大,用向上排空法收集,即用C收集,因二氧化碳不支持燃烧,可用燃着的木条检验二氧化碳是否收集满,故答案为:C;燃着的木条;
(3)若用装置A、C制取氧气,反应的特点为固体+固体$\stackrel{△}{→}$气体,可加热高锰酸钾制备氧气,反应的方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$ K2MnO4+MnO2+O2↑,
故答案为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$ K2MnO4+MnO2+O2↑.
点评 本题考查常见气体的制备以及仪器的使用,为高频考点,侧重于学生的分析、实验能力的考查,注意把握常见气体的制备原理和操作,难度不大.

练习册系列答案
相关题目
15.下列实验操作正确的是( )
| A. |  滴加液体 | B. | 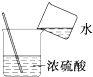 稀释浓硫酸 | C. |  检查气密性 | D. | 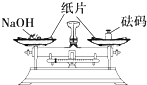 称量NaOH固体 称量NaOH固体 |
16.下列NH3的制备、收集或性质检验装置,正确的是( )
| A. |  制取收集 | B. |  排液收集 | C. |  尾气吸收 | D. |  喷泉实验 |
13.下列做法中,不利于保护水资源的是( )
| A. | 使用节水型马桶 | B. | 生活污水任意排放 | ||
| C. | 合理使用农药和化肥 | D. | 工业废水处理达标后排放 |
10.下列指定反应的离子方程式正确的是( )
| A. | 向NaOH溶液中通入过量CO2:2OH-+CO2=CO32-+H2O | |
| B. | 电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向H2O2溶液中加入MnO2:2H2O2+4H++MnO2=O2↑+Mn2++4H2O | |
| D. | 向KAl(SO4)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
17.氨氮废水中的氮元素多以NH4+和NH3•H2O的形式存在,在一定条件下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如图所示:
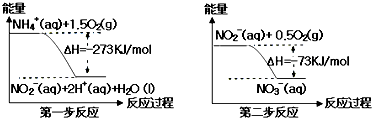
下列说法合理的是( )

下列说法合理的是( )
| A. | 该反应的催化剂是NO2- | |
| B. | 升高温度,两步反应速率均加快,有利于NH4+ 转化成NO3- | |
| C. | 在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态 | |
| D. | 1 mol NH4+在第一步反应中与1 mol NO2-在第二步反应中失电子数之比为1:3 |
14.现有短周期元素X、Y、Z、M,周期表中元素X的原子半径最小,Y原子最外层电子数是次外层的3倍,Z的化合物焰色反应为黄色,Y和M同主族.下列说法不正确的是( )
| A. | 气态氢化物的稳定性:Y<M | |
| B. | 简单离子半径由大到小的顺序是:M>Y>Z | |
| C. | 化合物Z2Y2 中含有离子键和非极性共价键 | |
| D. | 等浓度的X2M与Z2M的溶液中,水的电离程度:X2M<Z2M |
15.A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(B)>r(C)>r(D) | |
| B. | B的简单气态氢化物的热稳定性比D的弱 | |
| C. | E分别与A、C形成的化合物中化学键类型相同 | |
| D. | C的最高价氧化物对应水化物的碱性在同周期中最强 |