题目内容
9.下列实验中,实验操作、现象及结论都正确的是( )| 操 作 | 现 象 | 结 论 | |
| A | 向某溶液中滴加BaCl2溶液和稀HNO3 | 产生白色沉淀 | 溶液中一定含有SO42- |
| B | 淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 | 产生红色沉淀 | 淀粉水解可生成葡萄糖 |
| C | 向盛有0.5mol•L-1Fe(NO3)2溶液的试管中加入0.5mol•L-3H2SO4溶液 | 在试管口处现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| D | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液呈紫色 | 原溶液中有I- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.不能排除Ag+和SO32-的干扰;
B.水解生成的葡萄糖应在碱性条件下与氢氧化铜浊液反应;
C.溶液中NO3-被Fe2+还原为NO;
D.下层溶液呈紫色,说明生成碘.
解答 解:A.不能排除Ag+和SO32-的干扰,因AgCl不溶于酸,SO32-可被氧化生成SO42-,因先加入盐酸酸化,如无现象再加入氯化钡检验,故A错误;
B.淀粉在酸性条件下水解,水解生成的葡萄糖应在碱性条件下与氢氧化铜浊液反应,故B错误;
C.溶液中NO3-被Fe2+还原为NO,NO可进一步被氧化生成NO2,故C错误;
D.下层溶液呈紫色,说明生成碘,可说明原溶液中有I-,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的制备、淀粉的水解、离子检验等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验装置的作用及实验评价性分析,题目难度不大.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
19.己知:①CO(g)+H2O(g)═CO2(g)+H2(g)△H1,②CH4(g)+H2O(g)═CO(g)+3H2(g)△H2
下列推断正确的是( )
下列推断正确的是( )
| A. | 若CO的燃烧热为△H3,则H2的燃烧热为△H3-△H1 | |
| B. | 反应CH4(g)+CO2(g)═2CO(g)+2H2(g)的△H=△H${\;}_{{\;}_{2}}$-△H1 | |
| C. | 若反应②的反应物总能量低于生成物总能量,则△H2<0 | |
| D. | 若等物质的量的CO和H2完全燃烧生成气态产物时前者放热更多,则△H1>0 |
17.氨氮废水中的氮元素多以NH4+和NH3•H2O的形式存在,在一定条件下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如图所示:
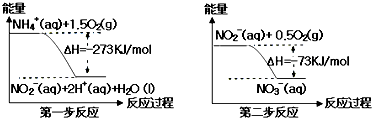
下列说法合理的是( )

下列说法合理的是( )
| A. | 该反应的催化剂是NO2- | |
| B. | 升高温度,两步反应速率均加快,有利于NH4+ 转化成NO3- | |
| C. | 在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态 | |
| D. | 1 mol NH4+在第一步反应中与1 mol NO2-在第二步反应中失电子数之比为1:3 |
14.现有短周期元素X、Y、Z、M,周期表中元素X的原子半径最小,Y原子最外层电子数是次外层的3倍,Z的化合物焰色反应为黄色,Y和M同主族.下列说法不正确的是( )
| A. | 气态氢化物的稳定性:Y<M | |
| B. | 简单离子半径由大到小的顺序是:M>Y>Z | |
| C. | 化合物Z2Y2 中含有离子键和非极性共价键 | |
| D. | 等浓度的X2M与Z2M的溶液中,水的电离程度:X2M<Z2M |
1.某学生以铁丝和Cl2为原料进行下列三个实验.从分类角度下列分析正确的是( )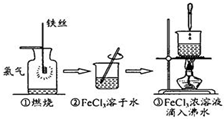

| A. | 实验①、③反应制得的物质均为纯净物 | |
| B. | 实验②、③均未发生氧化还原反应 | |
| C. | 实验②、③均为放热反应 | |
| D. | 实验①、②所涉及的物质均为电解质或非电解质 |
19.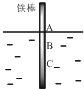 将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )
将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )
 将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )
将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )| A. | 铁棒AB段发生反应为O2+4e-+2H2O=4OH- | |
| B. | 腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段 | |
| C. | 向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响 | |
| D. | 产生这种现象的本质原因是铁棒所处的化学环境不同 |
 A、B、C、D、E是原子序数依次递增的短周期元素,A+无电子,BD与C2是等电子体,第一电离能:C>D>B,D和E同主族,ED2是形成酸雨的主要危害气体,F元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
A、B、C、D、E是原子序数依次递增的短周期元素,A+无电子,BD与C2是等电子体,第一电离能:C>D>B,D和E同主族,ED2是形成酸雨的主要危害气体,F元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.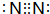 ,E属于元素周期表中ds区
,E属于元素周期表中ds区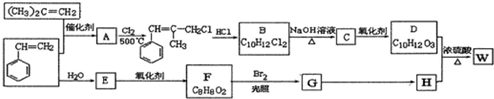
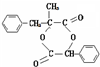 .
.  ;由D生成高分子化合物的方程式为
;由D生成高分子化合物的方程式为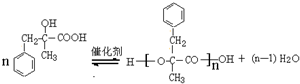 .
.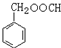 (写结构简式).
(写结构简式).