题目内容
【题目】某化学兴趣小组为合成1-丁醇,查阅资料得知如下合成路线:CH3CH=CH2+CO+H2![]() CH3CH2CH2CHO
CH3CH2CH2CHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
已知:CO的制备原理:HCOOH![]() CO↑+H2O.(常温下甲酸为液体)
CO↑+H2O.(常温下甲酸为液体)
(1)原料气CH3CH=CH2、CO和H2的制备均可用图1装置:
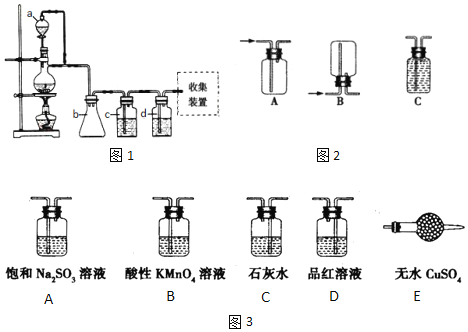
填写下列空白:
①若用上述装置制备氢气,收集装置可选用图2下列______装置
②若用上述装置制备干燥纯净的CO气体,装置b的作用是______;c中盛装的试剂是______。
为了控制生成一氧化碳的速度,则分液漏斗a中盛装的试剂是______。
③实验室用浓硫酸和2-丙醇制备丙烯时,还产生少量SO2、CO2及水蒸气,该小组用图3试剂检验这四种气体,混合气体通过试剂的顺序是______(填序号,试剂可以重复使用);写出2-丙醇与浓硫酸反应生成SO2、CO2及水蒸气的化学方程式______;
(2)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是______。
a.低温、高压、催化剂b.适当的温度、高压、催化剂
c.常温、常压、催化剂d.适当的温度、常压、催化剂
(3)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:
①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;
②沸点:乙醚34℃,1-丁醇118℃,并设计出如图提纯路线:
![]()
试剂1为______,操作3为______。
【答案】BC 防倒吸,安全瓶作用 NaOH溶液 HCOOH EDADCB CH3CH2OH+9H2SO4![]() 13H2O+9SO2↑+3CO2↑ b 饱和NaHSO3溶液 蒸馏
13H2O+9SO2↑+3CO2↑ b 饱和NaHSO3溶液 蒸馏
【解析】
根据实验原理、合成路线图及实验装置图分析选择正确实验装置并分析装置作用;根据物质性质书写相关反应方程式;根据影响反应速率的因素选择适合的反应条件;根据物质提纯和分离方法及路线图分析解答。
(1)①因为氢气不溶于水,密度比空气小,可以用排水法或向下排空气法收集,装置B或C符合题意,故答案为:BC;
②因为甲酸易溶于水,所以必须防止液体倒流,即b的作用是防止倒吸;甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸,CO 的制备原理:HCOOH ![]() CO↑+H2O。(常温下甲酸为液体)甲酸为反应物,浓硫酸为催化剂,为了控制生成一氧化碳的速度,则分液漏斗a中盛装的试剂是HCOOH,故答案为:防倒吸,安全瓶作用; NaOH溶液;HCOOH;
CO↑+H2O。(常温下甲酸为液体)甲酸为反应物,浓硫酸为催化剂,为了控制生成一氧化碳的速度,则分液漏斗a中盛装的试剂是HCOOH,故答案为:防倒吸,安全瓶作用; NaOH溶液;HCOOH;
③检验丙烯可以用酸性KMnO4溶液,检验SO2可以用酸性KMnO4溶液褪色、品红溶液或石灰水,检验CO2可以石灰水,检验水蒸气可以无水CuSO4,所以在检验这四种气体必须考虑试剂的选择和顺序。只要通过溶液,就会产生水蒸气,因此先检验水蒸气;然后检验SO2并在检验之后除去SO2,除SO2可以用饱和Na2SO3溶液,用品红溶液检验SO2是否除尽,最后检验CO2和丙烯,用石灰水检验CO2,再用酸性KMnO4溶液检验丙烯,则装置按气流方向的连接顺序为:EDADCB,浓硫酸具有强氧化性,能将乙醇氧化,反应方程式为:CH3CH2OH+9H2SO4![]() 13H2O+9SO2↑+3CO2↑,故答案为:EDADCB;CH3CH2OH+9H2SO4
13H2O+9SO2↑+3CO2↑,故答案为:EDADCB;CH3CH2OH+9H2SO4![]() 13H2O+9SO2↑+3CO2↑;
13H2O+9SO2↑+3CO2↑;
(2)由于反应是一个体积减小的可逆反应,所以采用高压,有利于增大反应速率和提高原料气的转化率,正向反应是放热反应,虽然低温有利于提高原料气的转化率,但不利于增大反应速率,因此要采用适当的温度,催化剂不能提高原料气的转化率,但有利于增大反应速率,缩短到达平衡所需要的时间,故正确所选项是b;故答案为:b;
(3)粗品中含有正丁醛,根据所给的信息利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇。因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开,故答案为:饱和NaHSO3溶液;蒸馏。