题目内容
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
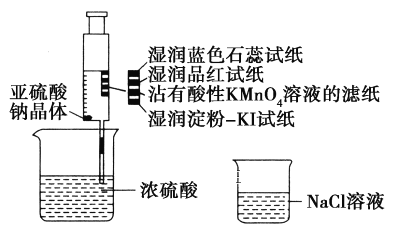
A. 蓝色石蕊试纸先变红后褪色
B. 品红试纸、沾有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性
C. 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2
D. NaCl溶液可用于除去实验中多余的SO2
【答案】C
【解析】
浓硫酸具有强酸性、吸水性,亚硫酸钠是一种弱酸盐,亚硫酸钠能与浓硫酸反应:Na2SO4+H2SO4=Na2SO4+SO2![]() +H2O,吸入少量浓硫酸后,注射器中充满了干燥的SO2气体,SO2具有还原性、漂白性、具有酸性氧化物的通性等性质,由此分析。
+H2O,吸入少量浓硫酸后,注射器中充满了干燥的SO2气体,SO2具有还原性、漂白性、具有酸性氧化物的通性等性质,由此分析。
浓硫酸具有强酸性、吸水性,亚硫酸钠是一种弱酸盐,亚硫酸钠能与浓硫酸发生反应:Na2SO4+H2SO4=Na2SO4+SO2![]() +H2O,吸入少量浓硫酸后,注射器中充满了干燥的SO2气体。
+H2O,吸入少量浓硫酸后,注射器中充满了干燥的SO2气体。
A. SO2溶解在湿润试纸的水溶液里生成H2SO3,H2SO3属于中强酸使石蕊变红,但SO2不能漂白指示剂,所以试纸变红后不会褪色,A项错误;
B.SO2使品红试纸褪色能证明SO2具有漂白性;SO2与酸性KMnO4能发生氧化还原反应:5SO2+2MnO4-+ 2H2O=5SO42-+2Mn2++ 4H+,SO2将紫色的MnO4-还原为几乎为无色的Mn2+而使滤纸褪色,所以SO2使沾有酸性KMnO4溶液的滤纸褪色不能证明SO2具有漂白性,B项错误;
C.湿润淀粉KI试纸未变蓝,说明SO2不能将I-氧化为I2,弱氧化剂不能制取强氧化剂所以SO2的氧化性弱于I2,C项正确;
D.SO2是一种大气污染物,多余的SO2通常用NaOH溶液吸收,NaCl不跟SO2反应且SO2不能完全被水吸收,所以不能用NaCl溶液吸收多余的SO2,D项错误;答案选C。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案