题目内容
【题目】依据氧化还原反应:Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如下图所示。
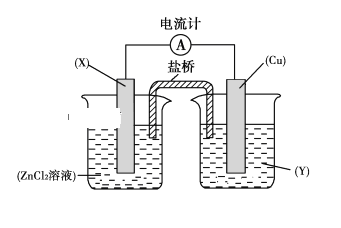
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________。
(2)铜电极为电池的________极,发生的电极反应为______________________,X极上发生的电极反应为________________。
(3)外电路中的电子是从________极流向________极。
(4)盐桥中的Cl-向________极移动,如将盐桥撤掉,电流计的指针将________偏转。
【答案】ZnCuCl2溶液正Cu2++2e-―→CuZn―→Zn2++2e-ZnCuZn不
【解析】
(1)由Zn(s)+Cu2+(aq)=Zn2+(aq)+Cu(s)反应可知,锌的化合价升高,被氧化,做负极,铜为正极,则电解质溶液为氯化铜。(2)铜为正极,是溶液中的铜离子得到电子,电极反应为:Cu2++2e-=Cu,锌为负极,失去电子生成锌离子,电极反应为Zn—2e-=Zn2+;(3)原电池工作时,电子从负极经过导线流向正极,所以从Zn流向Cu;(4)原电池工作时,阴离子向负极移动,即向Zn极移动,若将盐桥撤掉,则不能形成闭合回路,电流计的指针不能偏转。

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目