题目内容
【题目】硫酰氯(SO2Cl2)常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,实验装置如图所示(部分夹持装置未画出)。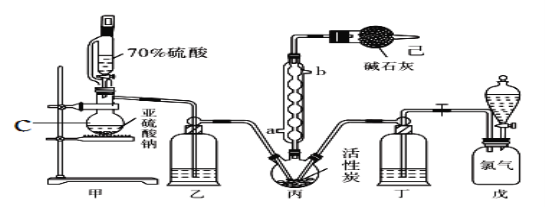
已知:硫酰氯通常条件下为无色液体,熔点54.1℃,沸点69.1℃。在潮湿空气中“发烟”;长期放置或者100°C以上发生分解,生成二氧化硫和氯气。
回答下列问题:
(1)仪器C的名称是_______________,冷凝管的进水方向______(填“a”或“b”)。
(2)下列操作或描述正确的是_________________。
A.将70%硫酸换成98.3%硫酸,可以加快制取SO2的速率
B.实验中通过观察乙、丁导管口产生气泡的速率相等,可控制两种反应物体积相等
C.装置戊上方分液漏斗中最好选用0.10 molL-1NaCl溶液,减小氯气的溶解度
D.装置己防止污染,又防止硫酰氯变质
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯,写出反应方程式:_____________。
(4)长期储存的硫酰氯会发黄,可能的原因是_________________________(用化学方程式和必要的文字加以解释)。
(5)若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为_______。(产率=![]() ×100%)
×100%)
【答案】蒸馏烧瓶aBD2ClSO3H![]() SO2Cl2 + H2SO4SO2Cl2=SO2+Cl2,分解产生少量的氯气溶解在其中75%
SO2Cl2 + H2SO4SO2Cl2=SO2+Cl2,分解产生少量的氯气溶解在其中75%
【解析】
(1)仪器C为蒸馏烧瓶,冷凝水的流向是“下进上出”,所以装置丙的冷凝管中冷凝水的入口是a;
(2)A.98.3%硫酸其中缺少水,硫酸并未完全电离,仍以分子形式存在,而Na2SO3(s)与H2SO4的反应是在H2SO4电离成离子的状态下才能顺利进行,故A错误;
B、实验中通过观察乙、丁导管口产生气泡的速率相等,即通入的二氧化硫和氯气的量相等,因此可控制两种反应物体积相等,故B正确;
C、装置戊上方分液漏斗中最好选用饱和1NaCl溶液,减小氯气的溶解度,故C错误;
D、装置己可吸收尾气二氧化硫和氯气,防止污染,同时阻止与潮湿的空气接触,防止硫酰氯变质,故D正确;
综上所述,本题应选BD;
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯,可根据质量守恒配平,反应方程式为;2ClSO3H![]() SO2Cl2 + H2SO4;
SO2Cl2 + H2SO4;
(4)由分解反应SO2Cl2=SO2+Cl2可知,分解产生少量的氯气,氯气为黄绿色,溶解在其中,会导致硫酰氯发黄;
(5)若反应中消耗的氯气体积为896 mL(标准状况下),氯气的物质的量为0.04mol,根据反应方程式SO2(g)+ Cl2(g) =SO2Cl2(l)可知,制备出的SO2Cl2(l)的物质的量为0.04mol,质量为0.04mol×135g/mol=5.4g,因此产率为4.05 g/5.4g×100%=75%。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D