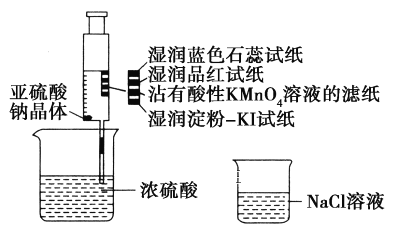
题目内容
【题目】(题文)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度的升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H_____0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为_____molL﹣1s﹣1。
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020molL﹣1s﹣1的平均速率降低,经10s又达到平衡。T_____100℃(填“大于”或“小于”),判断理由是_____________。

(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_____(填“正反应”或“逆反应”)方向移动。
【答案】大于0.001大于正反应方向为吸热反应,改变温度平衡向正反应方向移动。逆反应
【解析】
(1)N2O4无色, NO2呈红棕色,温度升高混合气体颜色变深,说明平衡正向移动,即正反应吸热,因此△H大于0;0~60s 反应速率v(N2O4)=(0.1-0.04)/60=0.001 molL﹣1s﹣1;正确答案:大于;0.001。
(2)改变反应温度使得c(N2O4)减小,故平衡正向移动,根据上述分析正反应吸热,因此温度升高,T大于100℃;正确答案:大于;正反应方向为吸热反应,改变温度平衡向正反应方向移动。
(3)正反应气体体积增大,因此体积减小压强增大,反应逆向移动;正确答案:逆反应。

【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
【题目】已知锌与稀盐酸反应放热,某学生为了探究反应过程中的速率变化,用排水集气法收集反应放出的氢气。所用稀盐酸浓度有1.00 mol·L-1、2.00 mol·L-1两种浓度,每次实验稀盐酸的用量为25.00 mL,锌有细颗粒与粗颗粒两种规格,用量为6.50 g。实验温度为298 K、308 K。
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
编号 | T/K | 锌规格 | 盐酸浓度/mol·L-1 | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和_______探究温度对该反应速率的影响; (Ⅲ)实验①和______探究锌规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
(2)实验①记录如下(换算成标况):
时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | span>100 |
氢气体积 (mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
①计算在30s~40s范围内盐酸的平均反应速率ν(HCl)=________(忽略溶液体积变化)。
②反应速率最大的时间段(如0s~10s......)为_______,可能原因是______。
③反应速率最小的时间段为________,可能原因是_________________________________。
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率,在不影响产生H2气体总量的情况下,你认为他上述做法中可行的是____________(填相应字母);
A.氨水 B.CuCl2溶液 C.NaCl溶液 D.KNO3溶液
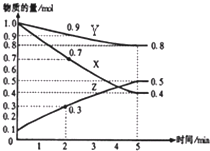
(4)另有某温度时,在2L容器中X、Y、Z物质的量随时间的变化关系曲线如下图所示,该反应的化学方程式为:_____________________________。
【题目】A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
物质组成 | 甲 | 乙 | 丙 | 丁 |
化合物中各元素原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
请回答下列问题:
(1)若元素E的某种核素中中子数比质子数多3个,表示这种核素的符号为___________;
(2)把D的单质放到NaOH溶液中,反应的离子方程式为:______________________;
(3)甲的电子式:____________________________________________;
(4)有100mL MgCl2和丙的混合溶液,其中c(Mg2+)=0.2mol·L-1,c(Cl-)=1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4mol·L-1NaOH溶液的体积是:________mL;
(5)在密闭容器中充入BC2、BC和乙的混合气体共mg,若加入足量Na2O2,并不断用电火花点燃至反应完全,测得固体质量增重mg,则BC2与乙的质量比为__________。