题目内容
12.在100℃和200kPa的条件下,密闭容器中进行的化学反应aA(g)?bB(g)+cC(g)达到平衡状态,在维持体系温度不变的条件下逐步压缩体积,体系压强也逐渐增大,测定不同压强下反应再次建立平衡时物质B的浓度,结果如表所示.| 压强(kPa) | 200 | 500 | 1000 |
| B的浓度(mol/L) | 0.04 | 0.1 | 0.27 |
(1)压强从200kPa增加到500kPa时,平衡不移动(填“正向”或“逆向”或“不”),理由是浓度增大的倍数和压强增大的倍数相同.
(2)压强从500kPa增加到1000kPa时,平衡正向移动(填“正向”或“逆向”或“不”),其原因可能为加压至1000kPa时,C物质变成了非气态物质.
(3)化学方程式中的化学计量数的关系是:a=b+c(填“?”“?”或“?”)
分析 (1)压强从 200kPa 增加到500kPa,增大了2.5倍,B的浓度从0.04mol/L增大到0.1mol/L,也增大了2.5倍,说明a=b+c,改变压强平衡不移动;
(2)压强增大的倍数为1000kPa/500kPa=2,B的浓度增大的倍数为0.27mol/L/0.1mol/L=2.7,浓度增大的倍数大于压强增大的倍数,所以平衡向“正向”移动;
(3)压强从 200kPa 增加到500kPa,增大了2.5倍,B的浓度从0.04mol/L增大到0.1mol/L,也增大了2.5倍,说明a=b+c,改变压强平衡不移动.
解答 解:(1)根据表中数据,压强从 200kPa增加到500kPa,增大了2.5倍,B的浓度从0.04mol/L增大到0.1mol/L,也增大了2.5倍,说明浓度增大的倍数和压强增大的倍数相同,化学计量数满足a=b+c,改变压强化学平衡不移动,
故答案为:不;浓度增大的倍数和压强增大的倍数相同;
(2)利用表中数据可知,压强增大的倍数为1000kPa/500kPa=2,B的浓度增大的倍数为0.27mol/L/0.1mol/L=2.7,浓度增大的倍数大于压强增大的倍数,说明加压至1000kPa时,C物质变成了非气态物质,所以增大压强化学平衡向“正向”移动,
故答案为:正向;加压至1000kPa时,C物质变成了非气态物质;
(3)由(1)得出,化学方程式中的化学计量数的关系是:a=b+c,故答案为:=.
点评 本题考查了化学平衡状态的影响因素,关键是分析题中表格的数据,得出正确结论,充分考查了学生的分析、理解能力,是一道不错的题目,本题难度中等.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
20.下列事实可证明氨水是弱碱溶液的是( )
| A. | 氨水能被弱酸醋酸中和 | |
| B. | 铵盐受热易分解 | |
| C. | 氨水可以使酚酞试液变红 | |
| D. | 0.lmol/L氨水溶液,常温时pH约为11 |
7.实验室测得4mol SO2参加下列反应:2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ•mol-1.当放出354kJ热量时SO2转化率最接近于( )
| A. | 10% | B. | 30% | C. | 50% | D. | 90% |
17.抗酸药中既能与强酸反应,又能与强碱反应的物质是( )
| A. | CaCO3 | B. | Al(OH)3 | C. | Mg(OH)2 | D. | MgCO3 |
2.下列叙述中,正确的是( )
| A. | H2SO4的摩尔质量是98 | |
| B. | 等质量的O2和O3中所含的氧原子数不同 | |
| C. | 等质量的SO2与SO3中所含硫原子数之比为5:4 | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L |
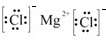 .
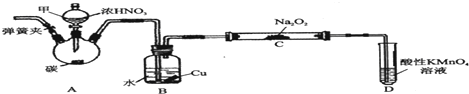
.

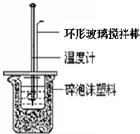 “中和热的测定”实验步骤为:
“中和热的测定”实验步骤为: