��Ŀ����
17����25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±�������˵��������ǣ�������| ���� | X | Y | Z |
| ��ʼŨ��/mol•L-1 | 0.1 | 0.2 | 0 |
| ƽ��Ũ��/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A�� | ��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50% | |
| B�� | �ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ�� | |
| C�� | ����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������ | |
| D�� | ��Ӧ�ɱ�ʾΪX+3Y?2Z����ƽ�ⳣ��Ϊ1600 |
���� A��X��ת����=$\frac{XŨ�ȱ仯��}{X��ʼŨ��}$��100%��
B��ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶ȱ仯��ƽ�ⳣ��Ҳ�����仯��
C��ƽ�ⳣ��ֻ���¶�Ӱ�죻
D��X��YŨ�ȼ�С��Ϊ��Ӧ�Z��Ũ������Ϊ�����������X��YŨ�Ȳ�Ϊ0��˵��Ϊ���淴Ӧ��X��Y��Z��ѧ������֮��Ϊ��0.1-0.05��mol/L����0.2-0.05��mol/L��0.1mol/L=1��3��2����Ӧ�ɱ�ʾΪX+3Y?2Z��ƽ�ⳣ��K=$\frac{{c}^{2}��Z��}{c��X����{c}^{3}��Y��}$��
��� �⣺A����Ӧ�ﵽƽ��ʱ��X��ת����Ϊ$\frac{��0.1-0.05��mol/L}{0.1mol/L}$=50%����A��ȷ��
B��ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�¶ȸı�ʱ����ѧƽ�ⳣ��һ���仯����B��ȷ��
C��ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬ѹǿ�ı�ƽ�ⳣ�����䣬��C����
D��X��YŨ�ȼ�С��Ϊ��Ӧ�Z��Ũ������Ϊ�����������X��YŨ�Ȳ�Ϊ0��˵��Ϊ���淴Ӧ��X��Y��Z��ѧ������֮��Ϊ��0.1-0.05��mol/L����0.2-0.05��mol/L��0.1mol/L=1��3��2����Ӧ�ķ���ʽΪX+3Y?2Z��ƽ�ⳣ��K=$\frac{{c}^{2}��Z��}{c��X����{c}^{3}��Y��}$=$\frac{0��{1}^{2}}{0.05��0.0{5}^{3}}$=1600����D��ȷ��
��ѡC��
���� ���⿼�黯ѧƽ����㡢ƽ�ⳣ�����㼰Ӱ�����أ��ѶȲ���ע��ƽ�ⳣ��ֻ���¶�Ӱ�죮

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | 50% | B�� | 60% | C�� | 80% | D�� | 90% |
��1��H2��g����CH3CH2OH��l����ȼ���ȣ���H���ֱ�Ϊ-285.8kJ•mol-1��-1365.5kJ•mol-1������ΪCO2������ȡ�Ҵ��ķ�Ӧ��2CO2��g��+6H2��g��?CH3CH2OH��l��+3H2O��l����H=-349.3kJ•mol-1
��2��д����Ӧ2CO2��g��+6H2��gC?H3CH2OH��g��+3H2O��g����ƽ�ⳣ������ʽ K=$\frac{c��C{H}_{3}C{H}_{2}OH��•{c}^{3}��{H}_{2}O��}{{c}^{2}��C{O}_{2}��•{c}^{6}��{H}_{2}��}$��һ��ѹǿ�£���ø÷�Ӧ��ʵ���������±��������������ݻش��������⣺
| �¶� CO2ת���� $\frac{n��{H}_{2}��}{n��C{O}_{2}��}$ | 500K | 600K | 700K | 800K |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
��3�����ܱ������У���H2��CO2�����ʵ���֮��Ϊ3��1����Ͷ�ϣ���5MPa�²�ò�ͬ�¶���ƽ����ϵ�и������ʵ����������y%����ͼ��1ʾ��
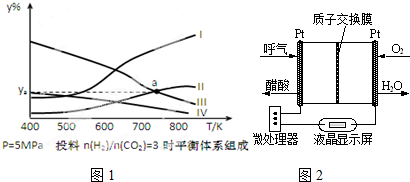
���������գ�
�ٱ�ʾCH3CH2OH����������ߵ��Ǣ���ѡ����ţ�
�����������㶨����������CO2�ķ�Ӧ���ʣ����Բ�ȡ�ķ�Ӧ������b��ѡ���ţ����ﵽƽ��������H2ת���ʵIJ�����ac��ѡ���ţ�
a�������¶� b����������H2
c����ȥ�Ҵ� d�������������
��ͼ1�����ߢ�͢�Ľ���a��Ӧ���������ya=18.75%
��4����ͼ2��ʾ��һ������ȼ�ϵ�ؾƾ�����ǣ������Զ����������������ƵĹ��ܣ��dz��ʺϽ����ֳ��ƾ���⣮��õ�صĸ�����ӦʽΪCH3CH2OH+H2O-4e-=CH3COOH+4H+��
| A�� | ��������������Ũ���Ṳ�ȷ�Ӧ | |
| B�� | ����������������������һ�������³�ַ�Ӧ | |
| C�� | ����ͭ��Ũ���Ṳ�ȷ�Ӧ | |
| D�� | ������ˮ����������Һ��Ӧ |
| A�� | C��CH3COOH�� | B�� | C��H+�� | C�� | C��H+��/C��CH3COOH�� | D�� | C��CH3COOH��/C��H+�� |
 ������ɢ���缫����
������ɢ���缫����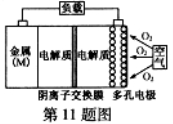 B���Ƚ�Mg��Al��Zn���ֽ����C������أ�Al�C������ص����۱��������
B���Ƚ�Mg��Al��Zn���ֽ����C������أ�Al�C������ص����۱�������� ��������ƣ�Na2S2O3�������������Լ������ﻹԭ���������ȡ������ֽ⣮��ҵ�Ͽ��÷�Ӧ��2Na2S+Na2CO3+4SO2�T3Na2S2O3+CO2�Ƶã�ʵ����ģ��ù�ҵ���̵�װ����ͼ��ʾ����˵����a��ʢ��ϡ���b��ʢ��Na2SO3���壩�ش��������⣺
��������ƣ�Na2S2O3�������������Լ������ﻹԭ���������ȡ������ֽ⣮��ҵ�Ͽ��÷�Ӧ��2Na2S+Na2CO3+4SO2�T3Na2S2O3+CO2�Ƶã�ʵ����ģ��ù�ҵ���̵�װ����ͼ��ʾ����˵����a��ʢ��ϡ���b��ʢ��Na2SO3���壩�ش��������⣺