题目内容
5.某固定容积的2L密闭容器中进行反应:N2+3H2$?_{高温高压}^{催化剂}$2NH3 起始时加入的N2、H2、NH3均为2mol,5min后反应达到平衡,NH3的物质的量为3mol,求:(1)这5分钟内用N2来表示该反应的反应速率(请写出计算过程).
(2)平衡时H2的物质的量浓度:0.25mol/L;平衡时容器的压强为初始时的$\frac{5}{6}$(填“几分之几”).
分析 起始时加入的N2、H2、NH3均为2mol,5min后反应达到平衡,NH3的物质的量为3mol,则:
N2(g)+3H2(g)?2NH3 (g)
起始量(mol):2 2 2
变化量(mol):0.5 1.5 1
平衡量(mol):1.5 0.5 3
(1)根据v=$\frac{△c}{△t}$计算v(N2);
(2)根据c=$\frac{n}{V}$计算平衡时H2的物质的量浓度,恒温恒容下,压强之比等于物质的量之比.
解答 解:起始时加入的N2、H2、NH3均为2mol,5min后反应达到平衡,NH3的物质的量为3mol,则:
N2(g)+3H2(g)?2NH3 (g)
起始量(mol):2 2 2
变化量(mol):0.5 1.5 1
平衡量(mol):1.5 0.5 3
(1)v(N2)=$\frac{\frac{0.5mol}{2L}}{5min}$=0.05mol/(L•min),
答:5分钟内用N2来表示的反应速率为0.05mol/(L•min);
(2)平衡时H2的物质的量浓度为$\frac{0.5mol}{2L}$=0.25mol/L,恒温恒容下,压强之比等于物质的量之比,平衡时容器的压强为初始时的$\frac{5mol}{6mol}$=$\frac{5}{6}$,
故答案为:0.25mol/L;$\frac{5}{6}$.
点评 本题考查化学平衡计算、反应速率计算,难度不大,注意三段式解题法在化学平衡计算中的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 改变温度可以改变此反应的平衡常数 | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| D. | 反应可表示为X+3Y?2Z,其平衡常数为1600 |
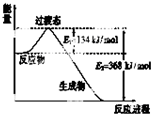 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1