题目内容
7.用水稀释0.1mol/L的醋酸溶液,其中随加水量的增加而增大的有( )| A. | C(CH3COOH) | B. | C(H+) | C. | C(H+)/C(CH3COOH) | D. | C(CH3COOH)/C(H+) |
分析 用水稀释0.1mol/L醋酸时,溶液中随着水量的增加,由CH3COOH?CH3COO-+H+可知,n(CH3COO-)、n(H+)增大,但溶液的体积增大的多,则C(CH3COO-)、c(H+)减小,则c(OH-)增大,加水促进电离,则c(CH3COOH)减少.
解答 解:A、加水稀释,促进醋酸电离,c(CH3COOH)减小,故A错误;
B、加水稀释,促进醋酸电离,则H+的物质的量增大,但氢离子的物质的量增大程度远远小于溶液体积增大程度,所以c(H+)减小,故B错误;
C、加水稀释,促进醋酸电离,但氢离子浓度减小,醋酸浓度也减小,但氢离子浓度减小的程度小于醋酸浓度减小的程度,所以$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}_{H})}$增大,故C正确;
D、加水稀释,促进醋酸电离,但氢离子浓度减小,醋酸浓度也减小,但氢离子浓度减小的程度小于醋酸浓度减小的程度,所以$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$减小,故D错误;
故选C.
点评 本题考查了弱电解质的电离,难度较大,加水稀释促进醋酸电离,氢离子的物质的量增大程度远远小于溶液体积增大程度,所以c(H+)减小,很多学生认为氢离子浓度增大,为易错点.

练习册系列答案
相关题目
17.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 改变温度可以改变此反应的平衡常数 | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| D. | 反应可表示为X+3Y?2Z,其平衡常数为1600 |
18.下表是元素周期表一部分,列出了十个元素在周期表中的位置:
请用化学用语回答下列问题:
(1)在①~⑦元素中,原子半径最大的是K(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)用电子式表示元素③与⑧形成化合物的过程 .
.
(4)写出⑤的最高价氧化物对应的水化物与②的最高价氧化物对应的水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | |||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑧ | ⑩ | ||
| 4 | ② | ④ | ⑨ |
(1)在①~⑦元素中,原子半径最大的是K(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)用电子式表示元素③与⑧形成化合物的过程
 .
.(4)写出⑤的最高价氧化物对应的水化物与②的最高价氧化物对应的水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
2.常温下,在下列溶液中发生如下反应:
①16H++10Z-+2XO${\;}_{4}^{-}$═2X2++5Z2+8H2O
②2A2++B2═2A3++2B- ③2B-+Z2═B2+2Z-
由此判断下列说法正确的是( )
①16H++10Z-+2XO${\;}_{4}^{-}$═2X2++5Z2+8H2O
②2A2++B2═2A3++2B- ③2B-+Z2═B2+2Z-
由此判断下列说法正确的是( )
| A. | 反应Z2+2A2+═2A3++2Z-不能进行 | |
| B. | Z元素在①③反应中均被氧化 | |
| C. | 氧化性由弱到强的顺序是XO${\;}_{4}^{-}$、Z2、B2、A3+ | |
| D. | 还原性由强到弱的顺序是A2+、B-、Z-、X2+ |
12.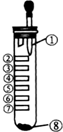 氯气性质的微型实验装置如图所示,①是浓盐酸,⑧是高锰酸钾,②至⑦是滤纸条,依次滴有品 红溶液、石蕊试液、淀粉KI试液、Na2S 溶液、KBr 溶液、含KSCN 的FeCl2几种溶液,实验时挤几滴浓盐酸,下列说法错误的是( )
氯气性质的微型实验装置如图所示,①是浓盐酸,⑧是高锰酸钾,②至⑦是滤纸条,依次滴有品 红溶液、石蕊试液、淀粉KI试液、Na2S 溶液、KBr 溶液、含KSCN 的FeCl2几种溶液,实验时挤几滴浓盐酸,下列说法错误的是( )
 氯气性质的微型实验装置如图所示,①是浓盐酸,⑧是高锰酸钾,②至⑦是滤纸条,依次滴有品 红溶液、石蕊试液、淀粉KI试液、Na2S 溶液、KBr 溶液、含KSCN 的FeCl2几种溶液,实验时挤几滴浓盐酸,下列说法错误的是( )
氯气性质的微型实验装置如图所示,①是浓盐酸,⑧是高锰酸钾,②至⑦是滤纸条,依次滴有品 红溶液、石蕊试液、淀粉KI试液、Na2S 溶液、KBr 溶液、含KSCN 的FeCl2几种溶液,实验时挤几滴浓盐酸,下列说法错误的是( )| A. | 产生氯气的离子方程式:16H++10Cl-+2MnO${\;}_{4}^{-}$=2Mn2++5Cl2↑+8H2O | |
| B. | ⑦处变血红色,是因为2Fe2++Cl2=2Fe3++2Cl-,Fe3++3SCN-=Fe(SCN)3 | |
| C. | ②褪色,③处先变红后褪色,⑤处出现淡黄色固体 | |
| D. | ④处变蓝,⑥处变橙红,能说明氧化性:Cl2>Br2>I2 |
19.已知反应A2(g)+2B2(g)?2AB2(g)的△H<0,达到平衡后,改变外界条件能使平衡正向移动的是( )
| A. | 升高温度 | B. | 增大压强 | C. | 使用催化剂 | D. | 增大AB2的浓度 |
16.胶体分散系与其它分散系的本质差别是( )
| A. | 分散质直径介于1~100nm之间 | B. | 是否有丁达尔效应 | ||
| C. | 是否稳定 | D. | 分散质粒子是否带电 |
17.一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2+3H2?2NH3,2min时测得剩余N2为1mol,此时化学反应速率表示不正确的是( )
| A. | υ(N2)=0.25mol/(L•min) | B. | υ(H2)=0.75mol/(L•min) | ||
| C. | υ(NH3)=1mol/(L•min) | D. | υ(NH3)=0.5mol/(L•min) |