题目内容
【题目】Ⅰ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g);△H>0
CO2(g)+3H2(g);△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为___。
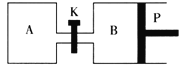
(2)如图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,维持其他条件不变,若打开K,一段时间后重新达到平衡,容器B的体积为___L(连通管中气体体积忽略不计,且不考虑温度的影响)。
Ⅱ.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)![]() CH3OH(g)
CH3OH(g)
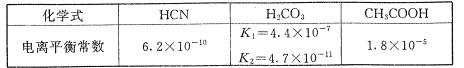
下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.27 | 0.012 |
(1)300℃下,将2molCO、6molH2和4molCH3OH充入2L的密闭容器中,判断反应___(填“正向”或“逆向”)进行。
(2)要提高CO的转化率,可以采取的措施是___(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
【答案】0.01mol·L-1·s-1 1.75a 正向 df
【解析】
Ⅰ. ⑴根据压强之比等于物质的量之比,得出20s时混合物的物质的量,再根据三段式建立关系,计算甲醇消耗得物质的量,再计算速率。
⑵先计算单独B容器达到平衡时的体积,再计算AB中容器所有物质反应后的物质的量的,再根据体积之比等于物质的量之比,得到反应后总的容器体积,再计算B容器的体积。
Ⅱ.⑴根据浓度商与平衡常数比较。
⑵根据温度升高,平衡常数减小,说明反应是放热反应,a.升温,平衡逆向移动,转化率降低;b.加入催化剂,平衡不移动,转化率不变;c.增加CO的浓度,平衡正向移动,但CO转化率降低;d.加入H2加压,平衡正向移动,CO转化率增大;e.加入惰性气体加压,平衡不移动,转化率不变;f.分离出甲醇,平衡正向移动,转化率增大。
Ⅰ.⑴一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则有![]() ,则n(20s)=4.8mol,
,则n(20s)=4.8mol,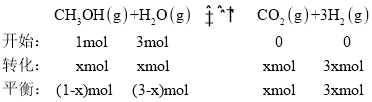
1x + 3x + x+3x = 4.8,则x = 0.4,甲醇表示该反应的速率为![]() ;故答案为:0.01mol·L-1·s-1。
;故答案为:0.01mol·L-1·s-1。
⑵如图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,根据![]() ,则
,则![]() ,得到B中反应后物质的量n(B) =5.4mol,为维持其他条件不变,若打开K,一段时间后重新达到平衡,A、B的比例相同,可以理解为全部混合,n(总) = 1mol+2mol+1.2mol+2.4mol = 6.6mol,根据B中容器反应前后物质的量的比例关系得出3.6mol:5.4mol = 6.6mol :n(反应后总),n(反应后总)= 9.9mol,再根据
,得到B中反应后物质的量n(B) =5.4mol,为维持其他条件不变,若打开K,一段时间后重新达到平衡,A、B的比例相同,可以理解为全部混合,n(总) = 1mol+2mol+1.2mol+2.4mol = 6.6mol,根据B中容器反应前后物质的量的比例关系得出3.6mol:5.4mol = 6.6mol :n(反应后总),n(反应后总)= 9.9mol,再根据![]() ,得到
,得到![]() ,V = 2.75a L,原来A容器为aL,因此容器B的体积为2.75a La L = 1.75aL ;故答案为:1.75a。
,V = 2.75a L,原来A容器为aL,因此容器B的体积为2.75a La L = 1.75aL ;故答案为:1.75a。
Ⅱ.⑴300℃下,将2molCO、6molH2和4molCH3OH充入2L的密闭容器中,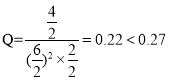 ,因此反应正向进行;故答案为:正向。
,因此反应正向进行;故答案为:正向。
⑵根据温度升高,平衡常数减小,说明反应是放热反应,
a.升温,平衡逆向移动,转化率降低,故a不符合题意;
b.加入催化剂,平衡不移动,转化率不变,故b不符合题意;
c.增加CO的浓度,平衡正向移动,但CO转化率降低,故c不符合题意;
d.加入H2加压,平衡正向移动,CO转化率增大,故d符合题意;
e.加入惰性气体加压,平衡不移动,转化率不变,故e不符合题意;
f.分离出甲醇,平衡正向移动,转化率增大,故f符合题意;
综上所述,答案为df。

 阅读快车系列答案
阅读快车系列答案