题目内容
18.写出下列物质的电子式NH3
 NaOH
NaOH HCl
HCl Cl2
Cl2 MgCl2
MgCl2 NaCl
NaCl N2
N2 H2O
H2O .
.
分析 首先判断单质或化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构.
解答 解:NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ;
;
NaOH是由钠离子和氢氧根离子构成的离子化合物,氢氧根离子中O与H以共价键相结合,其电子式为 ;
;
HCl属于共价化合物,不存在离子键,分子中氢原子与氯原子之间形成1对共用电子对,HCl电子式为 ;
;
Cl2分子中存在1个氯氯共用电子对,氯气分子的电子式为: ;
;
氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为: ;
;
NaCl为离子化合物,由钠离子与氯离子构成,电子式为: ;
;
N2的电子式为: ;
;
水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为: ,
,
故答案为: ;
; ;
; ;
; ;
; ;
; ;
; ;
; .
.
点评 本题考查电子式的书写知识,题目难度不大,结合物质的成键情况并根据电子式的书写规则解答.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
8.工业上电解熔融NaCl与电解食盐水都能直接得到的物质是( )
| A. | Na | B. | Cl2 | C. | H2 | D. | NaOH |
9.已知键能N≡N 946 kJ/mol,H-H 436kJ/mol,N-H 391kJ/mol.从理论上计算2NH3(g)?N2(g)+3H2(g)的△H为( )
| A. | -46 kJ/mol | B. | -92 kJ/mol | C. | +92 kJ/mol | D. | +1800kJ/mol |
6.已知t℃时AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,t℃时,在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
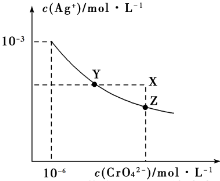

| A. | 在t℃时,Ag2CrO4的Ksp为1×10-12 | |
| B. | 在t℃时,AgCl的溶解度大于Ag2CrO4 | |
| C. | 在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X点 | |
| D. | 在t℃时,用AgNO3标准溶液滴定20mL未知浓度的KCl溶液,不能采用K2CrO4溶液为指示剂 |
7.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 生成物的总能量一定低于反应物总能量 | |
| B. | 吸热反应一定要加热条件才能进行 | |
| C. | 同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件的△H不同 | |
| D. | 用C(s)和CO(g)的燃烧热数据,可以计算化学反应C(s)+$\frac{1}{2}$O2(g)=CO(g)的焓变 |
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.