题目内容
10.①元素的非金属性越强,其对应最高氧化物水化物的酸性越强;②元素的金属性越强,其对应最高价氧化物水化物的碱性越强;
③元素的非金属性越强,其对应气态氢化物的稳定性越强.
分析 ①根据非金属性与最高价含氧酸酸性强弱的关系分析;
②根据金属性与碱性强弱的关系分析;
③根据金属性越强,氢化物越稳定判断.
解答 解:①元素的非金属性越强,其对应最高氧化物水化物的酸性越强;故答案为:强;
②元素的金属性越强,其对应最高氧化物水化物的碱性越强;故答案为:强;
③元素的非金属性越强,形成的共价键越稳定,其对应气态氢化物的稳定性越稳定;
故答案为:非金属;强.
点评 本题考查了元素性质的递变规律,把握非金属性和金属性的判断方法是解题的关键,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
20.根据表中给出的几种物质的熔沸点数据,判断下列说法错误的是( )
| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质硼 | |
| 熔点/℃ | 810 | 710 | 180 | -68 | 2300 |
| 沸点/℃ | 1 465 | 1 418 | 160 | 57 | 2 500 |
| A. | SiCl4是分子晶体 | B. | 单质硼可能是原子晶体 | ||
| C. | AlCl3加热能升华 | D. | NaCl的键的强度比MgCl2的小 |
5.关于锌、铜和稀硫酸构成的原电池的下列说法中正确的是( )
| A. | 锌是正极,铜是负极 | B. | 电子从铜片经导线流向锌片 | ||
| C. | 负极的反应式为2H++2e-=H2↑ | D. | 反应一段时间后,溶液的pH升高 |
15.按Si、P、S、Cl的顺序递增排列的是( )
①气态氢化物的稳定性 ②最高化合价 ③第一电离能 ④电负性.
①气态氢化物的稳定性 ②最高化合价 ③第一电离能 ④电负性.
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
2.硼有两种天然同位素105B和115B,硼元素的近似相对原子质量为10.80,则对115B的原子百分比是( )
| A. | 80% | B. | 20% | C. | 40% | D. | 无法计算 |
19.下列分子式只能表示一种物质的是( )
| A. | C3H7Cl | B. | CH2Cl2 | C. | C2H6O | D. | C6H6 |
20.已知1g氢气完全燃烧生成水蒸气时放出热量121kJ.且1mol 氧气分子中的化学键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为( )
| A. | 920 kJ | B. | 557 kJ | C. | 436 kJ | D. | 188 kJ |
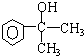 ;F
;F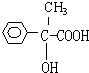 .
. ;
; .
. 、
、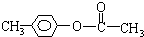 、
、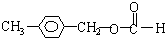 、
、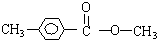 .
. NaOH
NaOH HCl
HCl Cl2
Cl2 MgCl2
MgCl2 NaCl
NaCl N2
N2 H2O
H2O .
.