题目内容
3.A、B、C、D为常见气态单质.已知:①A和B可以在放电条件下发生化合反应,其产物还可与B化合生成红棕色气体;
②C分别与A、B反应生成的两种化合物分子中都含有10个电子;
③C和D反应生成的化合物易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀.
请回答:(1)C和D反应生成的化合物1 mol所含的电子数18NA.
(2)上述②中化合物的热稳定性H2O强于NH3(填写化学式).
(3)将D通入B、C生成的化合物中,发生反应的化学方程式是Cl2+H2O=HCl+HClO.
分析 A、B、C、D为常见气态单质.
①A和B可以在放电条件下发生化合反应,其产物还可以与B化合生成红棕色气体,该红棕色气体为NO2,则A为氮气,B为氧气;
②C分别与N2、O2反应生成的两种化合物分子中都含有10个电子,则形成的化合物分别为NH3、H2O,所以C为H2;
③H2和D反应生成的化合物J易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀,该化合物为HCl,则D为Cl2;然后根据各物质的性质分析.
解答 解:A、B、C、D为常见气态单质,①A和B可以在放电条件下发生化合反应,其产物还可以与B化合生成红棕色气体,该红棕色气体为NO2,则A为氮气,B为氧气;②C分别与N2、O2反应生成的两种化合物分子中都含有10个电子,则形成的化合物分别为NH3、H2O,所以C为H2;③H2和D反应生成的化合物J易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀,该化合物为HCl,则D为Cl2,
(1)C和D反应生成的化合物为HCl,氯化氢分子中含有18个电子,1 molHCl分子中含有18mol电子,所含的电子数为18NNA,
故答案为:18;
(2)②中化合物为NH3、H2O,非金属性越强,对应氢化物稳定性越强,由于非金属性:N<O,则稳定性:H2O>NH3,
故答案为:H2O;NH3;
(3)D为氯气,B、C形成的化合物为H2O,氯气与水反应生成氯化氢和次氯酸,该反应的化学方程式为:Cl2+H2O=HCl+HClO,
故答案为:Cl2+H2O=HCl+HClO.
点评 本题考查无机推断,题目难度中等,涉及阿伏伽德罗常数的计算、元素周期律的应用及化学方程式书写等等再说,熟练掌握常见物质组成、性质为解答关键,试题培养了学生的分析、理解能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
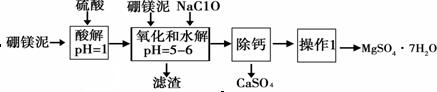
根据题意回答下列问题:
(1)实验中需用1mol•L-1的硫酸80mL,若用98%的浓硫酸配制,除量筒、玻璃棒外,还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管.
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
(3)在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+.
(5)已知MgSO4、CaSO4的溶解度如下表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明主要操作步骤蒸发浓缩、趁热过滤.
(6)如果提供的硼镁泥共100g,得到的MgSO4•7H2O 196.8g,则MgSO4•7H2O的产率为80%.

根据题意回答下列问题:
(1)实验中需用1mol•L-1的硫酸80mL,若用98%的浓硫酸配制,除量筒、玻璃棒外,还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管.
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
(3)在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+.
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)如果提供的硼镁泥共100g,得到的MgSO4•7H2O 196.8g,则MgSO4•7H2O的产率为80%.
14.如图是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
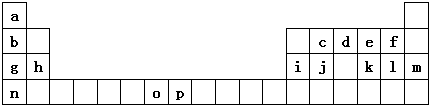
试回答下列问题:
(1)元素p的原子的电子占有7种能量不同的原子轨道.
(2)e、f、g、h四种元素形成的离子半径由大到小顺序为O2->F->Na+>Mg2+(用离子符号表示)
(3)单质d与单质a反应的产物的分子中中心原子的杂化形式为sp3,该分子是极性(填“极性”或“非极性”)分子.
(4)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:基态原子中电子获得能量跃迁到激发态,电子从能量较高的轨道跃迁到能力较低的轨道时,以光(子)的形式释放能量.
(5)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态p2+再失去一个电子难.对此,你的解释是Mn2+的外围电子排布为3d5,是半满状态较稳定,再失电子较难;Fe2+为3d6,失去一个电子后为半充满状态,因而相对易失去一个电子;
(6)a、d、e可以形成一种盐,此盐的组成中a、d、e元素的原子个数比为4:2:3,此盐的化学式为NH4NO3,含有的化学键为离子键、共价键、配位键.

试回答下列问题:
(1)元素p的原子的电子占有7种能量不同的原子轨道.
(2)e、f、g、h四种元素形成的离子半径由大到小顺序为O2->F->Na+>Mg2+(用离子符号表示)
(3)单质d与单质a反应的产物的分子中中心原子的杂化形式为sp3,该分子是极性(填“极性”或“非极性”)分子.
(4)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:基态原子中电子获得能量跃迁到激发态,电子从能量较高的轨道跃迁到能力较低的轨道时,以光(子)的形式释放能量.
(5)o、p两元素的部分电离能数据列于下表:
| 元素 | O | p | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(6)a、d、e可以形成一种盐,此盐的组成中a、d、e元素的原子个数比为4:2:3,此盐的化学式为NH4NO3,含有的化学键为离子键、共价键、配位键.
11.下列哪组离子能在水溶液中大量共存( )
| A. | K+、CO32-、HS-、S2-、Al3+、AlO2- | B. | MnO4-、Na+、SO42-、K+、Cl- | ||
| C. | SO42-、Ag+、SO32-、S2-、AlO2-、K+ | D. | Fe3+、Cl-、H+、NO3- |
15.按Si、P、S、Cl的顺序递增排列的是( )
①气态氢化物的稳定性 ②最高化合价 ③第一电离能 ④电负性.
①气态氢化物的稳定性 ②最高化合价 ③第一电离能 ④电负性.
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
 NaOH
NaOH HCl
HCl Cl2
Cl2 MgCl2
MgCl2 NaCl
NaCl N2
N2 H2O
H2O .
. ;
;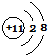 .D在周期表中位置第三周期第ⅥA族.
.D在周期表中位置第三周期第ⅥA族.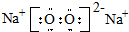 .
. 的不饱和度Ω为( )
的不饱和度Ω为( )