题目内容
8.工业上电解熔融NaCl与电解食盐水都能直接得到的物质是( )| A. | Na | B. | Cl2 | C. | H2 | D. | NaOH |
分析 电解熔融氯化钠生成氯气和钠,电解饱和食盐水生成氢氧化钠、氢气和氯气,据此解答.
解答 解:电解熔融氯化钠生成氯气和钠,方程式为:2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑;
电解饱和食盐水生成氢氧化钠、氢气和氯气,方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
所以二者都能得到的为氯气,
故选:B.
点评 本题考查了电解产物的判断,熟悉电解池工作原理及离子放电顺序是解题关键,题目难度不大.

练习册系列答案
相关题目
13.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
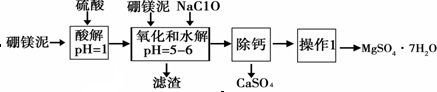
根据题意回答下列问题:
(1)实验中需用1mol•L-1的硫酸80mL,若用98%的浓硫酸配制,除量筒、玻璃棒外,还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管.
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
(3)在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+.
(5)已知MgSO4、CaSO4的溶解度如下表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明主要操作步骤蒸发浓缩、趁热过滤.
(6)如果提供的硼镁泥共100g,得到的MgSO4•7H2O 196.8g,则MgSO4•7H2O的产率为80%.

根据题意回答下列问题:
(1)实验中需用1mol•L-1的硫酸80mL,若用98%的浓硫酸配制,除量筒、玻璃棒外,还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管.
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
(3)在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+.
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)如果提供的硼镁泥共100g,得到的MgSO4•7H2O 196.8g,则MgSO4•7H2O的产率为80%.
20.根据表中给出的几种物质的熔沸点数据,判断下列说法错误的是( )
| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质硼 | |
| 熔点/℃ | 810 | 710 | 180 | -68 | 2300 |
| 沸点/℃ | 1 465 | 1 418 | 160 | 57 | 2 500 |
| A. | SiCl4是分子晶体 | B. | 单质硼可能是原子晶体 | ||
| C. | AlCl3加热能升华 | D. | NaCl的键的强度比MgCl2的小 |
17.下列事实中,不能作为元素金属性和非金属性强弱判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断钠和镁的金属性强弱 | |
| B. | 铁投入CuSO4溶液中置换出铜,判断铜与铁的金属性强弱 | |
| C. | 酸性H2CO3<HCl,判断氯与碳的非金属性强 | |
| D. | F2与Cl2分别与足量的H2反应的难易,判断氟与氯的非金属性强弱 |
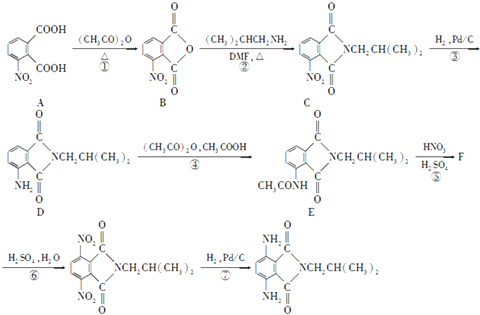
 )有还原性,易被氧化;
)有还原性,易被氧化;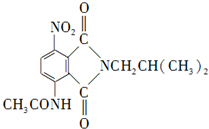 .
.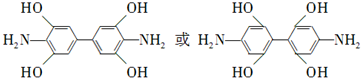 .
.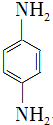 )是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
)是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下: .
. ,Y的结构式为
,Y的结构式为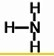 .
.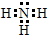 NaOH
NaOH HCl
HCl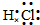 Cl2
Cl2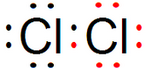 MgCl2
MgCl2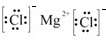 NaCl
NaCl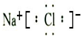 N2
N2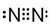 H2O
H2O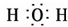 .
.