题目内容
9.已知键能N≡N 946 kJ/mol,H-H 436kJ/mol,N-H 391kJ/mol.从理论上计算2NH3(g)?N2(g)+3H2(g)的△H为( )| A. | -46 kJ/mol | B. | -92 kJ/mol | C. | +92 kJ/mol | D. | +1800kJ/mol |
分析 旧键断裂吸收的能量减去新键生成释放的能量值即为反应热,1molN2含有1molN≡N,1molH2含有1molH-H,1molNH3含有3molN-H,依据△H=反应物的总键能-生成物的总键能进行计算.
解答 解:已知:N≡N键的键能为946kJ/mol,H-H键能为436kJ/mol,N-H键键能为391kJ/mol,反应热△H=反应物的总键能-生成物的总键能,对于反应2NH3(g)?N2(g)+3H2(g)的△H,1molN2含有1molN≡N,1molH2含有1molH-H,1molNH3含有3molN-H,故△H=2×3×391-946kJ/mol-3×436kJ/mol=+92kJ/mol,
故选C.
点评 本题考查反应热的有关计算,掌握反应热与键能的关系是解答关键,题目难度不大.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
20.根据表中给出的几种物质的熔沸点数据,判断下列说法错误的是( )
| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质硼 | |
| 熔点/℃ | 810 | 710 | 180 | -68 | 2300 |
| 沸点/℃ | 1 465 | 1 418 | 160 | 57 | 2 500 |
| A. | SiCl4是分子晶体 | B. | 单质硼可能是原子晶体 | ||
| C. | AlCl3加热能升华 | D. | NaCl的键的强度比MgCl2的小 |
17.下列事实中,不能作为元素金属性和非金属性强弱判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断钠和镁的金属性强弱 | |
| B. | 铁投入CuSO4溶液中置换出铜,判断铜与铁的金属性强弱 | |
| C. | 酸性H2CO3<HCl,判断氯与碳的非金属性强 | |
| D. | F2与Cl2分别与足量的H2反应的难易,判断氟与氯的非金属性强弱 |
4.下列有关叙述中正确的是( )
| A. | 因为s轨道的形状是球形的,所以s电子做的是圆周运动 | |
| B. | 3px、3py、3pz的差异之处在于三者中电子(基态)的能量不同 | |
| C. | 原子轨道和电子云都是用来形象地描述电子运动状态的 | |
| D. | 电子云图上的每一个点都代表一个电子 |
14.如图是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
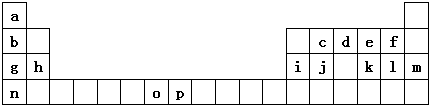
试回答下列问题:
(1)元素p的原子的电子占有7种能量不同的原子轨道.
(2)e、f、g、h四种元素形成的离子半径由大到小顺序为O2->F->Na+>Mg2+(用离子符号表示)
(3)单质d与单质a反应的产物的分子中中心原子的杂化形式为sp3,该分子是极性(填“极性”或“非极性”)分子.
(4)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:基态原子中电子获得能量跃迁到激发态,电子从能量较高的轨道跃迁到能力较低的轨道时,以光(子)的形式释放能量.
(5)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态p2+再失去一个电子难.对此,你的解释是Mn2+的外围电子排布为3d5,是半满状态较稳定,再失电子较难;Fe2+为3d6,失去一个电子后为半充满状态,因而相对易失去一个电子;
(6)a、d、e可以形成一种盐,此盐的组成中a、d、e元素的原子个数比为4:2:3,此盐的化学式为NH4NO3,含有的化学键为离子键、共价键、配位键.

试回答下列问题:
(1)元素p的原子的电子占有7种能量不同的原子轨道.
(2)e、f、g、h四种元素形成的离子半径由大到小顺序为O2->F->Na+>Mg2+(用离子符号表示)
(3)单质d与单质a反应的产物的分子中中心原子的杂化形式为sp3,该分子是极性(填“极性”或“非极性”)分子.
(4)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:基态原子中电子获得能量跃迁到激发态,电子从能量较高的轨道跃迁到能力较低的轨道时,以光(子)的形式释放能量.
(5)o、p两元素的部分电离能数据列于下表:
| 元素 | O | p | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(6)a、d、e可以形成一种盐,此盐的组成中a、d、e元素的原子个数比为4:2:3,此盐的化学式为NH4NO3,含有的化学键为离子键、共价键、配位键.
19.下列分子式只能表示一种物质的是( )
| A. | C3H7Cl | B. | CH2Cl2 | C. | C2H6O | D. | C6H6 |
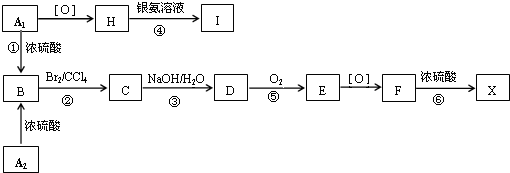
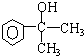 ;F
;F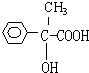 .
. ;
; .
. 、
、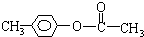 、
、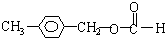 、
、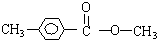 .
. NaOH
NaOH HCl
HCl Cl2
Cl2 MgCl2
MgCl2 NaCl
NaCl N2
N2 H2O
H2O .
.