题目内容
17.化学与生产生活息息相关.下列说法不正确的是( )| A. | 乙醇能消毒杀菌 | |
| B. | 锌可用作锌锰干电池的负极材料 | |
| C. | 糖类、油脂、蛋白质均是有机高分子化合物 | |
| D. | 硅可用于制造太阳能光电池 |
分析 A.乙醇可使蛋白质变性;
B.锌为活泼金属,可被氧化;
C.糖类中的单糖、二糖以及油脂不是高分子化合物;
D.晶体硅具有导电性.
解答 解:A.乙醇可使蛋白质变性,75%的酒精溶液可用于杀菌消毒,故A正确;
B.锌为活泼金属,可被氧化,为原电池的负极,故B正确;
C.高分子化合物的相对分子质量在1000以上,糖类中的单糖、二糖以及油脂不是高分子化合物,故C错误;
D.晶体硅具有导电性,可用于制造太阳能光电池,故D正确.
故选C.
点评 本题考查较为综合,涉及有机物的结构和性质、原电池以及硅的用途,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.反应A(g)+2B(g)?C(g)+D(g)+QkJ过程中的能量变化如图所示,有关叙述正确的是( )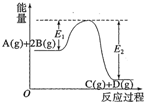

| A. | Q=E2 | |
| B. | 在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 | |
| C. | Q>0,仅升高温度,当反应再次达到平衡时,A的平衡浓度增大 | |
| D. | 1molA(g)和2molB(g)充分反应后放热QkJ |
5.如图图示与对应的叙述相符的是( )
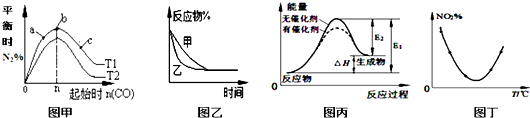

| A. | 图甲表示反应:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2 | |
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g)的影响,乙的压强比甲的压强大 | |
| C. | 图丙表示的反应是吸热反应,该图表明催化剂能改变化学反应的焓变 | |
| D. | 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |
6.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙变红色的溶液中:K+、Na+、SO42-、CO32- | |
| B. | pH=14的溶液中:K+、Na+、Cl-、AlO2- | |
| C. | 0.1 mol•L-1NH4I溶液中:Na+、Fe3+、Cl-、SO42- | |
| D. | 与铝反应产生大量氢气的溶液中:Na+、NH4+、HCO3-、NO3- |
 2H2(g)+O2(g) △H=+285.5k•Jmol-1
2H2(g)+O2(g) △H=+285.5k•Jmol-1 2NH3(g)△H=-38.6k•Jmol-1
2NH3(g)△H=-38.6k•Jmol-1
 ,属于分子晶体(填晶体类型).
,属于分子晶体(填晶体类型). I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.