题目内容
2.中学教材中常见的金属和非金属元素在工业和生活中有重要应用,请回答以下问题.(1)ⅦA族中溴与氯元素能形成BrCl,则其电子式为
 ,属于分子晶体(填晶体类型).
,属于分子晶体(填晶体类型).(2)从海水中提溴是将Cl2通入浓海水中,生成Br2,而Cl2氧化溴离子是在酸性条件下进行,其目的是为了避免Cl2发生歧化反应生成HCl和HClO.
(3)铜可催化NH3和F2发生反应:4NH3+3F2$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F,上述化学方程式中的五种物质所含化学键类型有abdf(填序号).
a.共价键 b.离子键 c.氢键 d.配位键 f.金属键
(4)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,则使溶液呈深蓝色的离子化学式为Cu+4NH3•H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-.
(5)高铁酸钾(K2FeO4)是一种新型高效水处理剂.高铁酸钾溶于水放出氧气,能杀菌消毒,生成能吸附水中悬浮物的物质.用一个离子方程式表示高铁酸钾水处理过程的原理4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-.
(6)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,该合金在一定条件下完全吸氢的反应方程式为:
Mg17Al12+17H2=17MgH2+12Al.1molMg17Al12完全吸氢后得到的混合物在4.0mol/LHCl溶液中能完全反应释放出H2,求反应中所消耗盐酸的体积为17.5L.
分析 (1)BrCl中Br原子、Cl原子之间形成1对个用电子式,属于分子晶体;
(2)氯气能与水反应生成HCl与HClO,酸性条件下抑制该反应的进行;
(3)氨气、氟气、NF3中均形成共价键,NH4F含有离子键、配位键、共价键,Cu中含有金属键;
(4)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,说明反应生成[Cu(NH3)4]2+,
(5)高铁酸钾溶于水放出氧气,能杀菌消毒,生成能吸附水中悬浮物的物质,即生成Fe(OH)3胶体;
(6)反应生成MgCl2、AlCl3,根据原子守恒计算消耗HCl的物质的量,进而计算需要HCl的体积.
解答 解:(1)BrCl中Br原子、Cl原子之间形成1对个用电子式,电子式为 ,属于分子晶体,
,属于分子晶体,
故答案为: ;分子;
;分子;
(2)氯气能与水反应生成HCl与HClO,酸性条件下避免Cl2发生歧化反应生成HCl和HClO,
故答案为:Cl2发生歧化反应生成HCl和HClO;
(3)氨气、氟气、NF3中均形成共价键,NH4F含有离子键、配位键、共价键,Cu中含有金属键,
故选:abdf;
(4)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,说明反应生成[Cu(NH3)4]2+,反应离子方程式为:Cu+4NH3•H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-,
故答案为:Cu+4NH3•H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-;
(5)高铁酸钾溶于水放出氧气,能杀菌消毒,生成能吸附水中悬浮物的物质,即生成Fe(OH)3胶体,反应离子方程式为:4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,
故答案为:4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-;
(6)1molMg17Al12完全吸氢后得到的混合物中有17molMgH2、12molAl,混合物与HCl溶液中能完全反应释放出H2,反应生成MgCl2、AlCl3及氢气,根据原子守恒可知:n(HCl)=2n(MgCl2)+3n(AlCl3)=17mol×2+12mol×3=70mol,故需要盐酸的体积为$\frac{70mol}{4mol/L}$=17.5L,
故答案为:17.5.
点评 本题属于拼合型题目,设计电子式、化学键、配合物、离子方程式书写、混合物的有关计算等,需要学生具备扎实的基础,(6)中注意利用守恒法解答,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | CH3COOH与HCN均为弱酸,酸性:HCN>CH3COOH | |
| B. | 25℃时,水电离出来的c(H+)均为 10-9mol/L的两种酸,酸的浓度:HCN>CH3COOH | |
| C. | 25℃时,浓度均为0.1mol/L 的CH3COONa和NaCN溶液中,pH大小:CH3COONa>NaCN | |
| D. | 25℃时,量取100m LpH=3的CH3COOH溶液加水稀释到1000m L,所得溶液由水电离的c(OH-)>10-10mol/L. |
| A. | 乙醇能消毒杀菌 | |
| B. | 锌可用作锌锰干电池的负极材料 | |
| C. | 糖类、油脂、蛋白质均是有机高分子化合物 | |
| D. | 硅可用于制造太阳能光电池 |
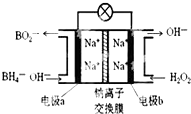 某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为:BH4-+8OH--8e-=BO2-+6H2O | |
| C. | b极上的电极反应式为:H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mole- |
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |

 硼是新型无机材料中的明星元索.
硼是新型无机材料中的明星元索. .
.