题目内容
12.某兴趣小组欲利用下列装置如图1探究A反应中Cl2的产生速率.
(1)完善A中反应:2KMnO4+16HCl═2MnCl2+5Cl2↑+2KCl+8H2O
A、B、C装置的接口连接顺序为:①→②→③→⑤→④(填数字序号).
(2)当黄绿色气体缓慢进入C时,一段时间后C中溶液才变蓝.C中溶液变蓝前发生反应的离子方程式为Cl2+SO32-+H2O=2Cl-+SO42-+2H+;少量淀粉KI溶液的作用是.
(3)若实验测得速率值偏小,小组同学作如下实验改进和反思,请帮助完成.
I用D装置代替C装置,目的是;
Ⅱ导致测得值偏小的原因可能还有:
①Cl2扩散需要一段时间②C中亚硫酸钠溶液浓度偏小,气体吸收速率小于A中气体生成速率(任答一点).
(4)进一步探究:仅将A装置做如右图2改变.则此改进欲探究的是浓度对反应速率的影响.
分析 (1)依据氧化还原反应中得失电子守恒以及元素守恒配平即可;BC装置分别为洗气和验证,故应“长进短出”,据此连接装置;
(2)亚硫酸钠具有还原性,氯气具有氧化性,能氧化亚硫酸根生成硫酸根,碘遇淀粉变蓝;据此解答即可;
(3)I.D装置与C装置的不同点在于D中加了一个多孔球泡,据此多孔气泡用途回答;
II.若气体吸收速率过慢,可以导致氯气的损失,亚硫酸钠的浓度太小,也可以导致气体吸收不完全,据此解答即可;
(4)将A装置做如图2改变,从图中得出改变的是HCl的浓度,据此解答即可.
解答 解:(1)KMnO4中Mn由+5价降低到MnCl2中的+2价,故发生还原反应,化合价变化为5,HCl中Cl从-1价升高到0价,故化合价变化为1,故氯气前系数为5,氯化锰为2,据此依据质量守恒定律得出:2KMnO4+16HC1═2MnCl2+5Cl2↑+2KCl+8H2O,B为除去氯气中HCl杂质气体,故应从②进入,C为验证气体装置,故应从⑤进入,
故答案为:2;16;2;5;2;8H2O;②;③;⑤;④;
(2)亚硫酸钠具有还原性,氯气具有氧化性,能氧化亚硫酸根生成硫酸根,在溶液中本身被还原生成氯离子,离子反应方程式为:Cl2+SO32-+H2O=2Cl-+SO42-+2H+,若溶液中存有亚硫酸根,就不会有碘单质生成,即此时淀粉KI试纸不变蓝,只有亚硫酸根完全反应,通入的氯气置换出KI中的碘生成碘碘单质,此时溶液变蓝,故淀粉KI为指示剂,
故答案为:Cl2+SO32-+H2O=2Cl-+SO42-+2H+;指示剂;
(3)I.D装置与C装置的不同点在于D中加了一个多孔球泡,利用多孔球泡可以将气体分散为小气泡,增大气体与溶液的接触面积,加快吸收速率,减少Cl2逸出,
故答案为:利用多孔球泡将气体分散为小气泡,增大气体与溶液的接触面积,加快吸收速率,减少Cl2逸出;
II.若气体吸收速率过慢,可以导致氯气的损失,亚硫酸钠的浓度太小,也可以导致气体吸收不完全,
故答案为:C中亚硫酸钠溶液浓度偏小,气体吸收速率小于A中气体生成速率;
(4)观察图可知:图2中把A中2.0mol/L的HCl换成了1.0mol/L的HCl,故此改进要探究的是难度对反应速率的影响,
答案为:浓度对反应速率的影响.
点评 本题主要考查的是化学反应速率的影响因素探究,题目难度中等,涉及氧化还原反应配平、气体制取装置连接、化学反应速率的影响等知识,注意掌握常见气体的制备方法,明确影响化学反应速率的因素,试题培养了学生的分析能力及化学实验能力.

| A. | 乙醇能消毒杀菌 | |
| B. | 锌可用作锌锰干电池的负极材料 | |
| C. | 糖类、油脂、蛋白质均是有机高分子化合物 | |
| D. | 硅可用于制造太阳能光电池 |
| A. | 金属腐蚀的本质是金属原子失去电子而被氧化 | |
| B. | 钢铁吸氧腐蚀的正极反应是:O2+4e-+2H2O=4OH- | |
| C. | 氢氧燃料电池中,氢气在负极发生氧化反应 | |
| D. | 将地下钢管与直流电源的正极相连,用来保护钢管 |
 减小
减小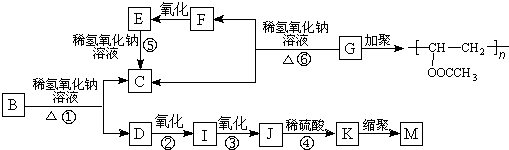
 .
. +3NaOH
+3NaOH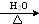 CH3COONa+
CH3COONa+ +NaBr+H2O.
+NaBr+H2O.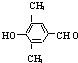 、
、 .
.

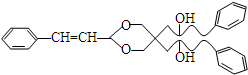
 .X与苯酚生成高聚物反应的化学方程式
.X与苯酚生成高聚物反应的化学方程式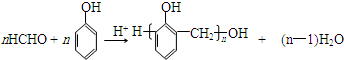 .
. .
. .
.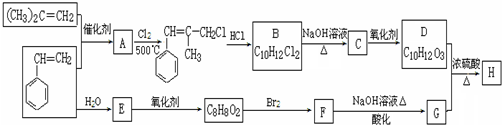
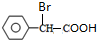 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$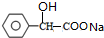 +NaBr+H2O.
+NaBr+H2O.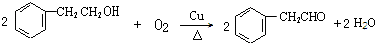 .
.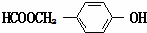 (写结构简式).
(写结构简式).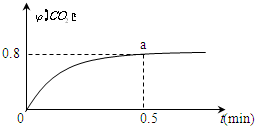 常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO.反应中CO2的体积分数φ(CO2)随时间的变化如图所示:
常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO.反应中CO2的体积分数φ(CO2)随时间的变化如图所示: