题目内容
9. I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.(1)钢制品应接电源的负极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-.若改用AlCl3水溶液作电解液,则阴极产物为H2 .
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有bd.
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,不能(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是Fe2O3+6H+=2Fe3++3H2O; Fe+2Fe3+=3Fe2+(用离子方程式说明).
Ⅱ.甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.工业上可用CO和H2制取甲醇,化学方程式为:
CO(g)+2H2(g)═CH3OH(g)△H=a kJ/mol,为研究平衡时CO的转化率与反应物投料比($\frac{{c(CO)}_{起始}}{{{c(H}_{2})}_{起始}}$)及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并绘出如图所示:
(1)反应热a<0 (填“>”或“<”).
(2)若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,A点的平衡常数KA=1,B点的平衡常数KB=KA(填“>”或“<”或“=”).
(3)为提高CO转化率可采取的措施是减小投料比、较低温度、增大压强、分离出CH3OH(至少答出两条).
分析 I、(1)依据电镀原理分析,钢铁上镀铝是利用铝做阳极,钢铁做阴极,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体做电解液来实现;改用AlCl3水溶液作电解液是溶液中氢离子在阴极放电生成氢气;
(2)铝热反应需要引发剂引发高温反应,用少量氯酸钾和镁条引发,点燃镁条燃烧放热使氯酸钾分解生成氧气助燃产生反应引发所需要的温度;铝热反应所得的固体混合物,将其溶于足量H2SO4,滴加KSCN溶液无明显现象,说明无铁离子,但不能说明固体中不含氧化铁,因为铝热反应生成铁,溶解于硫酸中铁可以还原铁离子为亚铁离子分析书写离子方程式;
Ⅱ、(1)分析图象可知,一氧化碳转化率随温度升高减小,说明平衡逆向进行分析反应能量变化;
(2)结合投料比较少氢气物质的量,依据化学平衡三段式列式计算平衡浓度,得到A点的平衡常数,AB是相同温度下的平衡,平衡常数只随温度变化分析;
(3)为提高CO转化率,可以增加氢气量,提高一氧化碳的转化率,反应是放热反应,降低温度平衡正向进行,依据反应特征和平衡移动原理分析提高一氧化碳转化率的条件是平衡正向进行.
解答 解:I、(1)依据电镀原理分析,钢铁上镀铝是利用铝做阳极与电源正极相连,钢铁做阴极与电源负极相连,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体做电解液来实现,离子液体是一种室温熔融盐,为非水体系,电镀过程中不产生其他离子且有机阳离子不参与电极反应,则阴极反应生成铝是发生的还原反应,铝元素化合价降低,分析离子液体成分,结合电荷守恒分析可知是Al2Cl7-得到电子生成,电极反应为:4Al2Cl7-+3e-=Al+7AlCl4-;改用AlCl3水溶液作电解液是溶液中氢离子在阴极放电生成氢气,2H++2e-=H2↑;
故答案为:负;4Al2Cl7-+3e-=Al+7AlCl4-;H2 ;
(2)铝热反应需要引发剂引发高温反应,用少量氯酸钾和镁条引发,点燃镁条燃烧放热使氯酸钾分解生成氧气助燃产生反应引发所需要的温度;铝热反应所得的固体混合物,将其溶于足量H2SO4,滴加KSCN溶液无明显现象,说明无铁离子,但不能说明固体中不含氧化铁,因为铝热反应生成铁,溶解于硫酸中铁可以还原铁离子为亚铁离子,离子方程式为:Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+;
故答案为:bd;不能;Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+;
Ⅱ、(1)图象可知,一氧化碳转化率随温度升高减小,说明平衡逆向,正反应为放热反应,a<0,
故答案为:<;
(2)若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,n(H2)=20mol,
CO(g)+2H2(g)═CH3OH(g)
起始量(mol/L) 1 2 0
变化量(mol/L) 0.5 1 0.5
平衡量(mol/L) 0.5 1 0.5
A点的平衡常数KA =$\frac{0.5}{0.5×1{\;}^{2}}$=1
AB是相同温度下的平衡,平衡常数只随温度变化,所以AB平衡常数相同;
故答案为:1;=;
(3)为提高CO转化率可采取的措施,可以增加氢气量,提高一氧化碳的转化率,反应是放热反应,降低温度平衡正向进行,依据反应特征和平衡移动原理分析提高一氧化碳转化率的条件是平衡正向进行,即减小投料比、较低温度、增大压强、分离出CH3OH;
故答案为:减小投料比、较低温度、增大压强、分离出CH3OH.
点评 本题考查了电解原理的分析应用铝热反应原理分析,化学平衡、平衡常数,反应速率影响因素分析判断,化学平衡计算,化学平衡的建立过程分析应用,掌握基础是关键,题目难度中等.

| A. | 乙醇能消毒杀菌 | |
| B. | 锌可用作锌锰干电池的负极材料 | |
| C. | 糖类、油脂、蛋白质均是有机高分子化合物 | |
| D. | 硅可用于制造太阳能光电池 |
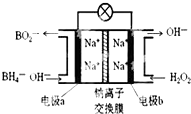 某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为:BH4-+8OH--8e-=BO2-+6H2O | |
| C. | b极上的电极反应式为:H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mole- |
| A. | NaCl常用于保存食物 | |
| B. | 烹鱼时加入少量酒、食醋,美味又营养 | |
| C. | 糖类、油脂、蛋白质均为高分子化合物 | |
| D. | 燃煤中加入CaCO3,可减少SO2气体对大气的污染 |



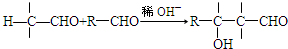

 .X与苯酚生成高聚物反应的化学方程式
.X与苯酚生成高聚物反应的化学方程式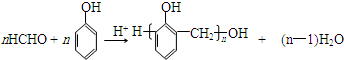 .
.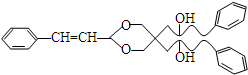 .
. .
.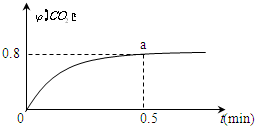 常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO.反应中CO2的体积分数φ(CO2)随时间的变化如图所示:
常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO.反应中CO2的体积分数φ(CO2)随时间的变化如图所示:
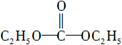 .
.